Número Atual: Outubro-Dezembro 2019 - Volume 3 - Número 4
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
ARTIGO ESPECIAL
Guia para o manejo da asma grave 2019 – Associação Brasileira de Alergia e Imunologia
Guide to the management of severe asthma 2019 – Brazilian Association of Allergy and Immunology
Gustavo F. Wandalsen1; Flávio Sano2; Ana Carla A. M. Falcão3; Adelmir S. Machado4; Faradiba S. Serpa5; José Ângelo Rizzo3; José Elabras Filho6; Pedro Giavina-Bianchi7; Tessa R. T. Gonçalves1; Dirceu Solé1
DOI: 10.5935/2526-5393.20190050
1. Escola Paulista de Medicina - Universidade Federal de São Paulo, São Paulo, SP, Brasil
2. Hospital Nipo-Brasileiro, São Paulo, SP, Brasil
3. Universidade Federal de Pernambuco, Recife, PE, Brasil
4. Programa de Controle da Asma - Universidade Federal da Bahia, Salvador, BA, Brasil
5. Universidade Federal do Espírito Santo, Vitória, ES, Brasil
6. Universidade Federal do Rio de Janeiro, Rio de Janeiro, RJ, Brasil
7. Faculdade de Medicina - Universidade de São Paulo, São Paulo, SP, Brasil
Endereço para correspondência:
Dirceu Solé
E-mail: dirceu.sole@unifesp.br
Submetido em: 10/11//2019
Aceito em: 10/12/2019.
Não foram declarados conflitos de interesse associados à publicação deste artigo.
RESUMO
Antes de rotular um paciente como tendo asma grave, é crucial confirmar o diagnóstico da doença e de sua gravidade, além de excluir diagnósticos diferenciais de condições que podem se assemelhar ou se confundir com a asma, tais como: tuberculose, doença pulmonar obstrutiva crônica, disfunção de corda vocal, apneia do sono, bronquiectasia, entre outras. Neste guia são abordados, além dos diagnósticos diferenciais, dados de história clínica e exames laboratoriais que permitem classificar o paciente com relação à evolução da doença (controlado ou não controlado) e, assim, possibilitar a instituição do esquema terapêutico mais apropriado. São apresentadas alternativas terapêuticas disponíveis para a abordagem clínica desses pacientes, incluindo os imunobiológicos.
Descritores: Asma grave, controle da asma, corticosteroide inalado, imunobiológicos, qualidade de vida, anticorpos monoclonais.
I - ASMA E SEU DIAGNÓSTICO
A asma é uma doença inflamatória crônica heterogênia com limitação variável aos fluxos aéreos e hiper-reatividade brônquica. Sintomas tais como falta de ar, sibilos, tosse e opressão torácica podem estar presentes e variar em intensidade ao longo do tempo1.
Indivíduos com sintomas persistentes e sugestivos de asma devem ter o diagnóstico estabelecido por elementos da história, exame clínico e medidas objetivas de função pulmonar. Confirmado o diagnóstico de asma, a gravidade e o nível de controle da doença devem ser identificados, e o tratamento mais adequado àquela condição iniciado prontamente. Definir e estabelecer a gravidade da doença tem sido um enorme desafio para médicos clínicos e especialistas.
O diagnóstico de asma grave é também um diagnóstico por exclusão. Antes de rotular um paciente como tendo asma grave, é crucial confirmar o diagnóstico e refutar diagnósticos diferenciais de condições que podem se assemelhar ou se confundir com a asma, tais como tuberculose, doença pulmonar obstrutiva crônica (DPOC), disfunção de corda vocal, apneia do sono, bronquiectasia, entre outras2,3. Estudo de coorte canadense avaliou pacientes adultos com diagnóstico recente de asma realizado por médicos, que foi descartado em 33% deles4. Suspeitas diagnósticas alternativas devem ser elaboradas, notadamente para aqueles pacientes considerados como tendo asma, mas que não apresentem resposta à terapia preconizada para a doença, ou que apresentem função pulmonar preservada3,4.
Outra condição intrínseca à definição de asma grave é diferenciá-la da asma de difícil controle, condição em que fatores externos dificultam o controle dos sintomas, como exposições ambientais nocivas e comorbidades, aderência inadequada ao tratamento e o uso incorreto dos dispositivos inalatórios1,3.
Definição
Nas últimas três décadas, diversas associações e organizações internacionais compostas por especialistas e peritos no tema, propuseram recomendações para a classificação da gravidade da asma e seu manejo. Esses documentos sofreram atualizações de acordo com o conhecimento fisiopatogênico crescente da doença1,5,6. As definições e classificações de asma grave basearam-se notadamente em resposta ao tratamento e, ao longo do tempo, versões atualizadas destas diretrizes foram periodicamente publicadas. A dificuldade em definir um espectro de doença está diretamente relacionada à heterogeneidade e complexidade da asma, incluindo seus diferentes fenótipos e endotipos. O melhor conhecimento sobre os endotipos da asma permitiu a formulação de definições mais precisas da doença, estratégias de prevenção e tratamento individualizado2. Serão apresentadas a seguir algumas definições contidas nas principais diretrizes internacionais.
Uniformização da definição de asma grave
a) Organização Mundial de Saúde (OMS)
Em 2010, Bousquet e cols. propuseram uma uniformização para definição de asma grave, controle e exacerbações baseados em definições e conceitos de diretrizes anteriormente publicadas7. O documento produzido por esse grupo de especialistas foi elaborado com o intuito de ser utilizado amplamente em países de baixa, média e alta renda per capita. Para essa definição de gravidade, foram adotados conceitos tais como o nível de controle, nível de tratamento prescrito, técnica inalatória, resposta à terapia empregada e risco7. A gravidade da asma foi considerada pelos autores como uma característica intrínseca de cada indivíduo na expressão de sua doença.
Nesse documento, conceituou-se asma grave como "asma não controlada" que pode resultar em risco de exacerbações frequentes (ou morte) e/ou reações adversas a medicações e/ou morbidade crônica". A asma grave foi classificada em três grupos:
– G1: Asma grave não tratada (uso incorreto de medicação ou prescrição inadequada, má técnica de uso do dispositivo ou baixa aderência à terapia);
– G2: Asma grave de difícil tratamento (eventos adversos e difícil otimização da terapia);
– G3: Asma grave resistente ao tratamento (asma não controlada a despeito do tratamento adequado – asma refratária e resistente ao corticoide).
b) Força-tarefa da Sociedade Respiratória Europeia (ERS) e Sociedade Torácica Americana (ATS)
A força-tarefa da ERS/ATS8 definiu asma grave como "asma que requer tratamento com doses elevadas de corticosteroide inalatório (CI) e agente beta 2-agonista de longa duração (LABA) ou anti-leucotrieno/teofilina no ano anterior, ou uso de corticosteroide oral (CO) em pelo menos 50% dos dias do ano anterior para prevenir o descontrole ou, ainda, aqueles que permanecem não controlados a despeito desta terapia". Esta diretriz definiu asma não controlada na presença de um dos seguintes tópicos:
i) ausência de controle de sintomas [Asthma Control Questionnaire (ACQ) > 1,5 ou Asthma Control Test (ACT) < 20];
ii) exacerbações frequentes: dois ou mais pulsos de corticosteroide oral por três ou mais dias, nos últimos 12 meses;
iii) exacerbação grave: hospitalização, internação em unidade de terapia intensiva (UTI) ou uso de ventilação mecânica nos últimos 12 meses;
iv) limitação dos fluxos aéreos após uso de broncodilatador; ou
v) asma controlada que piora com a redução dessas doses elevadas de CI ou CO (ou imunobiobiológicos adicionais).
c) Sociedade Torácica Canadense
A diretriz canadense publicada em 20176 promoveu adaptações das definições de asma grave e asma não controlada a partir do documento elaborado pela força-tarefa da ERS/ATS. Desta forma, a definição de asma grave e asma não controlada tornaram-se mais extensas e detalhadas:
"Asma grave" foi definida como a asma que requer tratamento com altas doses de CI e um segundo medicamento de controle no ano anterior, ou uso de corticosteroides sistêmicos em 50% dos dias do ano anterior para evitar que a asma se torne "descontrolada" ou que permaneça "descontrolada", apesar de sua terapia.
"Asma não controlada" definida como pelo menos um dos seguintes tópicos:
1) controle inadequado dos sintomas – conforme critérios da Sociedade Canadense para controle da asma ou de outros questionários padronizados: ACQ > 1,5, ACT < 20; ou Children-Asthma Control Test (cACT) < 20;
2) exacerbações graves frequentes: dois ou mais ciclos de corticosteroides sistêmicos (por três dias) nos últimos 12 meses;
3) exacerbações graves: pelo menos uma internação em UTI ou ventilação mecânica nos últimos 12 meses;
4) limitação do fluxo aéreo: após uso de broncodilatador apropriado para manter o volume expiratório forçado no primeiro segundo (VEF1) < 80% do previsto (ou menor que o limite inferior do normal [LLN]), em face da redução do VEF1 / capacidade vital forçada (CVF), definida como menor do que o LLN.
d) Iniciativa Global para Asma
Em 2019, a atualização da diretriz da GINA1 considerou asmático grave um subgrupo dos asmáticos de difícil tratamento. Asma de difícil tratamento foi definida como asma que permanece não controlada apesar de tratamento com medicamentos da etapa 4 ou 5 (corticosteroide inalado em doses médias ou altas associado a um segundo medicamento de controle e/ou corticosteroide oral de manutenção) ou que necessita de tais medicamentos para manter o controle dos sintomas e reduzir o risco de exacerbações. Asma grave foi definida como um subgrupo da asma de difícil tratamento, caracterizada por asma não controlada apesar da terapia otimizada e do manejo adequado dos fatores associados, como adesão e técnica inalatória1. A gravidade da asma pode ser avaliada retrospectivamente de acordo com o nível de tratamento requerido para controle dos sintomas e para evitar exacerbações1.
A gravidade per se é um atributo dinâmico da doença, e pode modificar-se ao longo do tratamento. As definições de gravidade da doença da ERS/ATS de 20178, o Position Statement canadense de 20176, e a GINA de 20191 são similares, e baseiam-se em classificações para pacientes sob tratamento. Deve-se considerar, ainda, que a gravidade seja verificada ao longo do tratamento, correlacionando-se o perfil do tratamento empregado com o nível controle dos sintomas. Sob tratamento padrão otimizado, a grande maioria dos pacientes com asma obterá o controle dos sintomas, recuperará a função pulmonar, e apresentará formas mais leves ou moderadas da doença.
Deve-se considerar primariamente como tendo asma grave o indivíduo com diagnóstico firmado da doença, sob tratamento adequado, que apresente boa aderência à terapia e técnica inalatória adequada. Especial atenção deve ser oferecida a pacientes com histórico de asma quase fatal, internações em UTI ou submetidos à ventilação mecânica, e indivíduos com obstrução fixa aos fluxos aéreos, independentemente do estrato de classificação de gravidade da doença.
II – AVALIAÇÃO DO CONTROLE DA DOENÇA
O controle da asma depende do controle dos sintomas, da redução do risco futuro de exacerbações, da melhora da função pulmonar e da ausência de eventos adversos relacionados ao uso de medicamentos1,7.
Os dois domínios relacionados ao controle da asma, controle dos sintomas e risco futuro, precisam ser periodicamente e sistematicamente avaliados. Tem sido documentado que a ausência de controle dos sintomas é um fator de risco relevante para exacerbações. Adicionalmente, intubação orotraqueal, internação em UTI e exacerbações graves nos últimos 12 meses são fatores de risco independentes que contribuem para desfechos desfavoráveis em pacientes com asma. Outros fatores de risco modificáveis contribuem para exacerbações nesses pacientes, tais como: ausência de aderência ao tratamento, uso incorreto de dispositivos, e prescrição isolada de fármacos de alívio e/ou tratamento sem a prescrição de CI1,8.
Médicos e pacientes podem subestimar os sinais e sintomas da asma e, portanto, apresentar má percepção da gravidade da obstrução brônquica9. A má percepção pode concorrer para a ausência de controle da doença, exacerbações, asfixia e morte9,10. Diversos métodos de avaliação podem ser empregados para o monitoramento da asma, tais como questionários e escalas, medidas objetivas de função pulmonar e biomarcadores (óxido nítrico exalado, eoninofilia, entre outros).
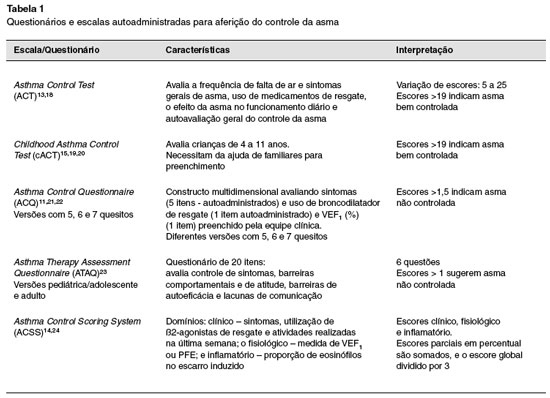
Questionários e escalas para aferição do nível de controle dos sintomas de asma têm sido indicados para avaliar a resposta ao tratamento e manejo da doença11-15. Esses instrumentos geralmente são simples, e podem ser respondidos pelo próprio paciente para facilitar a mensuração objetiva do manejo da asma. Todavia, muitos desses instrumentos aferem exclusivamente o controle dos sintomas, e alguns deles, a exemplo do Asthma Control Scoring System (ACSS)14, incorporaram domínios de mensuração mais complexos, como a eosinofilia do escarro, característica essa que inviabiliza o seu uso na prática clinica diária e o restringe a centros ou serviços especializados em atendimento de pacientes com asma grave. A Tabela 1 relaciona alguns dos principais instrumentos disponíveis para aferição do controle da asma.
A utilização dos questionários para avaliação do controle da asma deve ser estimulada e difundida entre clínicos e especialistas. Essas escalas devem ser simples e de fácil aplicação, a exemplo do questionário utilizado pela GINA, o ACQ5 (cinco quesitos) e o ACT, ambos já algo difundidos em nosso meio entre especialistas. Esta prática pode auxiliar na redução da subjetividade na avaliação de médicos e pacientes em relação ao controle dos sintomas no momento da consulta.
As medidas objetivas para aferir o controle da doença, tais como função pulmonar e biomarcadores, são interessantes e podem ser utilizadas, mas nem sempre são instrumentos amplamente disponíveis na prática clínica. Baixos valores de VEF1 são reconhecidos como sendo um importante fator de risco para exacerbações e, usualmente, recomenda-se que asmáticos realizem exames de função pulmonar regulares, especialmente os pacientes de risco1. Entretanto, a correlação entre os sintomas da asma e a função pulmonar não é forte, e entende-se que a função pulmonar consiste em um domínio separado na doença, como papel no diagnóstico, na fenotipagem e no monitoramento dos pacientes.
O controle da asma aferido pela classificação da GINA foi comparado prospectivamente com o ACQ7, ACQ5 e o ACT em 150 adultos com asma. O ACQ7 e o ACT previram a asma não controlada pela GINA em 71% e 81% dos pacientes. Resultados similares foram observados para o ACQ5. O ACQ7 e o ACT foram capazes de identificar um número maior de pacientes com asma não controlada, quando comparados à classificação da GINA17. Esses resultados sugerem que os distintos questionários e a classificação GINA identificam satisfatoriamente os pacientes com asma não controlada.
O uso de instrumentos tais como o ACT e ACQ para a avaliação do controle da asma deve ser estimulado e difundido em nosso meio entre especialistas e médicos generalistas. Contudo, para a realidade brasileira, sugerimos que a diretriz GINA seja utilizada para balizar os conceitos de gravidade e de controle da asma, por ser acessível e mais difundido entre os especialistas em nosso país, sendo os questionários de avaliação de controle utilizados como ferramentas complementares nesse processo.
Avaliação do paciente com asma grave
A avaliação sistemática do paciente com sintomas de asma que não alcança o controle da doença nas etapas 4 ou 5 da GINA é fundamental, pois possibilita a confirmação do diagnóstico de asma grave, e também uma abordagem diferenciada, com possibilidade de terapia específica, que pode proporcionar o controle da doença1,25,26. A avaliação deve compreender etapas que obrigatoriamente terão que ser seguidas, e que incluem a confirmação do diagnóstico de asma e a investigação de causas de não controle (checagem de técnica inalatória, avaliação da adesão, persistência de exposição ambiental, pesquisa de comorbidades)1,25. Nesse contexto, todas essas questões devem ser consideradas antes de se estabelecer o diagnóstico de asma grave e indicar terapia com imunobiológico27.
Etapa 1- Diagnóstico de asma
A confirmação do diagnóstico de asma exige história clínica detalhada com informações sobre sintomas comuns à asma (dispneia, sibilância, tosse e opressão torácica), desencadeantes, frequência e evolução dos sintomas, e resposta aos tratamentos prévios.
O diagnóstico definitivo deve ser sustentado pela confirmação de limitação ao fluxo expiratório, determinada pela documentação de um ou mais dos critérios abaixo, avaliados em exame de função pulmonar (espirometria ou medida de pico de fluxo expiratório):
– relação VEF1/CVF < 75% em adultos;
– aumento de 200 mL e 12% no VEF1 basal, 15 minutos após o uso de 400 µg de salbutamol ou equivalente;
– variabilidade média diurna no pico de fluxo expiratório (PFE) acima de 10% entre medidas matinais e vespertinas ao longo de duas semanas;
– redução de 20% ou mais no VEF1 basal em teste de broncoprovocação com metacolina ou equivalente;
– redução maior que 10% e 200 mL no VEF1 basal após teste de exercício físico;
– aumento no VEF1 acima de 200 mL após quatro semanas de uso de corticosteroide inalatório em dose alta associado a LABA, ou duas semanas de corticosteroide sistêmico1.
Caso na espirometria inicial não seja documentada reversibilidade, ou seja, a variação do VEF1 for menor que 200 mL e 12%, o exame pode ser repetido quando o paciente estiver sintomático1,26. Ao longo do tratamento da asma pode ocorrer aumento da função pulmonar e redução da variabilidade ao fluxo aéreo1, portanto é importante avaliar espirometrias prévias. Por outro lado, em alguns pacientes, a obstrução pode se tornar fixa ou irreversível ao longo do tempo1. Muitas vezes, pacientes com obstrução fixa são diagnosticados apenas por critérios clínicos, entretanto, recomenda-se nesses casos reduzir a etapa de tratamento com posterior reavaliação, ou realizar espirometria após 15 dias em uso de corticosteroide sistêmico para que se documente a reversibilidade e se firme o diagnóstico de asma de forma mais objetiva1,28,29. Em estudo de vida real realizado na Dinamarca, em que foram avaliados mais de 1.500 pacientes com sintomas de asma, apenas 50% dos pacientes tinham o diagnóstico de asma confirmado objetivamente, mesmo sendo acompanhados por especialistas pelo tempo mínimo de dois anos30.
Cabe ressaltar que a espirometria é importante não só na avaliação inicial para confirmar o diagnóstico de asma, mas também, ao longo do tempo para determinar a efetividade do tratamento. Portanto, é recomendado que o exame seja realizado por profissional habilitado, seguindo padrões internacionais e/ou nacionais, e que os resultados preencham critérios de aceitabilidade e reprodutibilidade. Exames que não preenchem esses critérios podem induzir erros de interpretação31.
Além do exame de função pulmonar, a tomografia de alta resolução (TCAR) deve ser solicitada, pois permite fazer o diagnóstico de doenças que podem mimetizar a asma ou mesmo interferir no seu controle, como no caso de doença pulmonar obstrutiva crônica (DPOC) e de bronquiectasias32.
Etapa 2 - Investigação de causas de não controle
Após confirmação do diagnóstico de asma, devem ser investigadas causas de não controle da doença. Na maioria das vezes, o não controle não se deve à gravidade da asma, mas sim a fatores relacionados ao próprio indivíduo, ao ambiente, condições socioeconômicas e outros que possam direta ou indiretamente interferir no controle da doença.
a) Técnica inalatória
O uso de dispositivos inalatórios requer técnica apropriada e está associado a alta frequência de erros, tanto em asmáticos jovens quanto em idosos, mesmo nos com seguimento em ambulatório especializado33. Os avanços tecnológicos permitiram o desenvolvimento de dispositivos mais fáceis de manusear, entretanto, o uso dos inaladores continua a ser um problema sério associado ao não controle da asma34,35.
Erros de técnica inalatória são bastante comuns e observados em até 80% dos pacientes1,25, independente do inalador empregado34, o que pode resultar em subdosagem de medicamentos e redução da efetividade do tratamento36-38. A habilidade em usar o dispositivo inalatório deve ser considerada na prescrição1. Entretanto, estudos mostram que até 25% dos pacientes nunca receberam treinamento para uso dos dispositivos, e aqueles que o recebem, são treinados de modo inadequado, e não é reforçado periodicamente39.
Estudo de vida real, em que os autores realizaram 2.288 observações de técnica inalatória, os erros foram associados à idade avançada, menor escolaridade e não treinamento pelas equipes de saúde34. Além disso, os pacientes que não executavam a técnica inalatória adequadamente apresentaram risco maior de hospitalização, atendimento em emergência e uso de corticosteroide sistêmico, confirmando o impacto negativo dos erros de técnica inalatória sobre o controle da asma34.
A redução dos erros de técnica ao longo do tempo melhora a resposta ao tratamento35, o que reforça ser o treinamento fundamental para que a técnica inalatória seja correta. Dependendo da faixa etária, uma abordagem diferenciada pode ser necessária, como no caso dos idosos, que podem necessitar de atividades educacionais específicas para melhor compreensão sobre o uso dos dispositivos33. Outra observação relevante é que ao longo do tempo, o paciente volta a cometer erros na técnica inalatória35,40, por isso, é necessário checá-la em todas as consultas. Dessa forma, é importante o uso de checklist ou vídeos que possam facilitar o treinamento da técnica inalatória1, e, assim, contribuir para a efetividade do tratamento.
b) Adesão e acesso ao tratamento
Além da técnica inalatória, a adesão ao tratamento deve ser regularmente checada, e o paciente deve ser questionado enfaticamente sobre a frequência de uso do medicamento de controle e eventuais dificuldades e barreiras para seu uso, incluindo custo e efeitos colaterais1. Estudos mostram que entre 40 e 65% dos pacientes com asma de difícil controle apresentam problemas de adesão ao tratamento41.
As causas de baixa adesão ao tratamento da asma incluem fatores diversos, relacionados aos medicamentos, regime de tratamento e fatores relacionados ao próprio indivíduo e à sociedade1,42,43. Fatores relacionados ao medicamento e regime de uso incluem: dificuldade em usar o dispositivo inalatório, posologia, diferentes dispositivos para uso simultâneo. Fatores relacionados ao indivíduo e socioeconômicos incluem: não compreensão das instruções, esquecimento, ausência de rotina diária, percepção de que o tratamento não é necessário, negação ou irritação decorrente da doença, expectativas inapropriadas, receio dos efeitos colaterais, insatisfação com a equipe de saúde, estigmatização, questões culturais e religiosas, uso de fórmulas populares, dificuldade de acesso às consultas de acompanhamento, dificuldade de acesso ao medicamento e o custo. O acesso aos medicamentos é uma barreira ao tratamento e deve sempre ser questionado, pois a dificuldade em adquirir o medicamento pode levar à baixa adesão, tanto nos serviços privados, quanto nos públicos.
No últimos anos, dispositivos móveis – mobile health – passaram a ser utilizados no apoio à prestação de cuidados de saúde com transferência de informações que podem melhorar a adesão ao tratamento da asma, conforme verificado por Jeminiwa e cols. em revisão sistemática recente44.
Nesse contexto, no atendimento do paciente com diagnóstico confirmado de asma grave, são necessárias formas diferenciadas de abordagem, visando afastar possíveis causas de não controle que estejam relacionadas a erros de técnica inalatória, problemas de acesso e baixa adesão ao tratamento. Frente a estas necessidades, é recomendado que esses pacientes sejam avaliados em Centros de Referência em Asma, por equipe multidisciplinar. Além disso, políticas públicas que visem implementar atividades educativas para profissionais de saúde envolvidos no atendimento de pacientes com asma, inclusive na atenção básica, podem contribuir para a abordagem adequada da asma em todos os níveis de atenção à saúde.
c) Exposição ambiental
A avaliação do ambiente do paciente com diagnóstico de asma é fundamental, e deve ser realizada no início do tratamento e ao longo do tempo. Essa abordagem possibilita a identificação de fatores que aumentam o risco de exacerbações e, dessa forma, contribuem para o não controle e agravamento da asma e baixa qualidade de vida25. Devem ser investigados: tabagismo ativo e passivo, exposição a alérgenos no ambiente domiciliar e de trabalho, fontes de poluição intra e extradomiciliar e uso de medicamentos como betabloqueadores e anti-inflamatórios não esteroidais1.
A prevalência de tabagismo entre pacientes com asma grave não está estabelecida, até mesmo porque os tabagistas ativos são excluídos dos estudos sobre asma grave45. Entretanto, no estudo de coorte TENOR - The Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens e no registro de asma grave da Britsh Thoracic Society, que não excluíram tabagistas ativos, a prevalência observada foi de 6% e 4%, respectivamente46,47. Esse percentual está abaixo do observado em um estudo global de prevalência de asma, que incluiu asmáticos de um modo geral, no qual foi observada prevalência de 23%48. Fumantes ativos têm maior número de visitas à Emergência, necessidade de cursos de corticosteroide sistêmico e pior controle da asma quando comparados aos asmáticos que nunca fumaram ou que são ex-fumantes45. Além disso, um percentual desses pacientes pode ter DPOC ou sobreposição das duas doenças, asma e DPOC (ACO - Asthma-COPD Overlaping Syndrome), o que deverá ser considerado. Medidas que promovam a cessação do tabagismo são fundamentais no tratamento da asma e da ACO.
Os potenciais alérgenos intra e extradomiciliares deverão ser identificados com base na história clínica. Pesquisar sensibilização para alérgenos suspeitos, pelo teste cutâneo de leitura imediata ou dosagem de IgE sérica específica, contribui para identificação daqueles que são relevantes para o paciente, além de contribuir para estabelecer o fenótipo da asma1. Exposição a alérgenos no ambiente de trabalho deve sempre ser investigada. A asma relacionada ao trabalho geralmente tem gravidade maior, cursa com declínio mais rápido da função pulmonar e está relacionada a pior controle da doença49.
Medicamentos betabloqueadores, tanto os de uso sistêmico quanto tópico, têm risco potencial de causar broncoconstricção e resposta insuficiente aos broncodilatadores beta 2-agonistas durante exacerbação de asma. Alguns betabloqueadores são cardiosseletivos (atenolol, bisoprolol, metoprolol), entretanto, essa propriedade é dose-dependente. Assim, a asma não é contraindicação absoluta para o uso desses betabloqueadores cardiosseletivos, mas os riscos e benefícios devem ser considerados1. Metanálise que avaliou alterações na função pulmonar e a eficácia dos beta 2-agonistas após uso de betabloqueador documentou que os betabloqueadores cardiosseletivos foram bem tolerados, mas não isentos de riscos, e que podem ser mitigados pelo uso das menores doses possíveis desses fármacos50.
A intolerância à aspirina e aos anti-inflamatórios não hormonais pode desencadear sintomas de rinite e asma, como ocorre na doença respiratória exacerbada pela aspirina (DREA). A doença tem início com sintomas de rinite, que progridem para rinossinusite crônica com polipose nasossinusal, e posteriormente, asma1. Pacientes com DREA apresentam maior número de visitas à Emergência, hospitalizações e uso de corticosteroides sistêmicos quando comparados àqueles que não apresentam intolerância à aspirina51. Metanálise documentou ser a prevalência de DREA em asmáticos de 7%, e de 15% nos com asma grave55. O padrão-ouro para o diagnóstico é o teste de provocação com aspirina, e a dessensibilização pode ser realizada52.
d) Comorbidades
A asma grave tem sido foco de intensa pesquisa voltada para terapias guiadas pelo fenótipo da doença. Entretanto, está bem estabelecido que comorbidades contribuem substancialmente para o não controle da asma, e devem sempre ser consideradas frente a um paciente com sintomas não controlados, antes de estabelecer o fenótipo5,27.
Diversas comorbidades podem ser confundidas com asma ou estarem associadas à asma e influenciar no controle da doença, ou ainda constituir um fenótipo distinto, como a asma relacionada à obesidade53,54. Estudo recente documentou que 92% dos pacientes com asma grave apresentavam uma ou mais comorbidades, e que as características que mais se associaram à presença delas foram idade avançada, sexo feminino, história de tabagismo e o uso crônico de corticosteroide sistêmico55. Diversos estudos comprovam que a presença de comorbidades está associada a maior frequência de exacerbações, não controle da asma e pior qualidade de vida56.
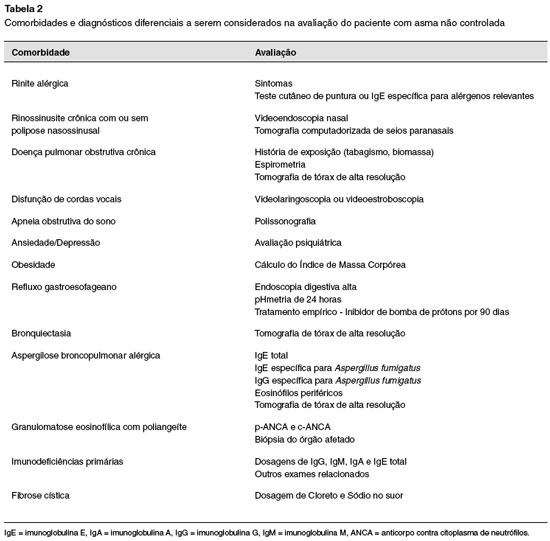
As principais comorbidades extrapulmonares associadas à asma são: rinite alérgica (RA), rinossinusite crônica (RSC), doença do refluxo gastroesofágico (DRGE), síndrome da apneia obstrutiva do sono (AOS), disfunção das cordas vocais (DCV), respiração disfuncional (RD) e obesidade. É comum a coexistência de várias dessas comorbidades no paciente com asma grave32. A pesquisa dessas comorbidades deve ser realizada por história clínica, exames complementares e, em algumas situações, questionários específicos validados podem servir de guia para a identificação dessas doenças32. Na Tabela 2 encontram-se as principais comorbidades e/ou diagnósticos diferenciais a serem considerados na avaliação do paciente com asma não controlada.
A RA é comorbidade comum, e evidências robustas sustentam a relação e o seu impacto sobre a asma57. Os sintomas (obstrução nasal, espirros, coriza) são facilmente identificados, e chamam atenção os achados característicos à rinoscopia anterior (palidez e hipertrofia de conchas nasais). No estudo de coorte U-BIOPRED – Unbiased BIOmarkers in PREDiction of respiratory disease outcomes, rinite foi identificada em 70% dos pacientes com asma grave, sendo 55% alérgica, e 15% não alérgica58.
A RSC, com ou sem pólipos, está frequentemente associada à asma e pode agravar os seus sintomas56,59, aumentando o risco de exacerbações em até quatro vezes56. É descrita em até 45% dos pacientes com asma grave60, e a RSC com polipose está associada à asma grave eosinofílica e baixa função pulmonar59. Obstrução nasal, cefaleia, rinorreia ou secreção pós-nasal são sintomas comuns. O diagnóstico é baseado na presença desses sintomas e achados de tomografia de seios paranasais. DREA também é descrita em associação com RSC e polipose nasal em 15% dos pacientes com asma grave56. Percentual elevado, quando comparado com a população de asmáticos em geral, cuja prevalência observada em uma metanálise foi 7%52.
A DRGE é descrita como uma das principais comorbidades relacionadas à asma, principalmente a asma grave. Em diferentes casuísticas de pacientes com asma grave, a frequência varia entre 41% e 67%61. Pacientes asmáticos com DRGE são mais sintomáticos, e a gravidade da asma é maior. Um percentual dos pacientes pode não apresentar sintomas digestivos62, mas mesmo nesses casos a possibilidade de DRGE deve ser considerada. O impacto do tratamento da DRGE no controle da asma ainda não está estabelecido. A GINA sugere o uso empírico de inibidor de bomba de prótons durante 90 dias em pacientes com quadro clínico sugestivo de DRGE associado à asma1.
Outra comorbidade que pode atrapalhar o controle da asma e gerar dúvidas quanto ao diagnóstico é a disfunção de cordas vocais (DCV). A DCV caracteriza-se por adução involuntária das cordas vocais durante a inspiração, ocorre mais no sexo feminino e pode coexistir com a asma, ou mesmo mimetizá-la. Os sintomas de DCV podem ser precipitados por estresse, exercício físico, irritantes extrínsecos e intrínsecos como produtos químicos e refluxo gastroesofágico, respectivamente63. Estudo de caso-controle documentou prevalência de 19% de DCV em adultos com asma, e de 5% em controles sem a doença64. Em revisão de dados clínicos de 1.020 pacientes com DCV, os sintomas mais frequentes foram dispneia (73%), chiado (36%), estridor (28%) e tosse (25%)63. Os autores desta revisão chamam atenção para o fato de que a ausculta de chiado ou estridor de origem laríngea durante uma crise de asma é indicativo de associação com DCV. Na espirometria, atenção deve ser dada à curva fluxo-volume inspiratória, pois essa pode apresentar-se achatada nos casos de DCV63. O diagnóstico é confirmado por videolaringoscopia, entretanto, como a disfunção pode ser intermitente, o exame pode ser normal e necessitar ser realizado sob algum estímulo específico, por exemplo exercício físico65. O tratamento consiste em fonoterapia e suporte psicológico.
A apneia obstrutiva do sono (AOS) está na maioria das vezes relacionada a outras comorbidades associadas à asma, como DRGE, RSC e obesidade, condições que potencializam o impacto negativo sobre o controle da asma66. A AOS caracteriza-se por colapso repetitivo das vias aéreas superiores resultando em roncos, despertar noturno, sonolência diurna excessiva e dessaturação de oxigênio. Em revisão sistemática recente, a prevalência de AOS em asmáticos graves foi de 50% a 95%, percentual superior ao observado na população geral de asmáticos, que foi de 19% a 60%66. O uso de questionários validados pode contribuir para a identificação de pacientes sob risco para AOS.
A respiração disfuncional (RD) é descrita como alterações crônicas ou recorrentes em padrão de respiração, causando sintomas respiratórios similares aos sintomas da asma. A fisiopatologia da RD não está totalmente esclarecida, mas o estresse emocional pode precipitar episódios67. A RD pode ser confundida com a asma, ou estar associada à asma e, também, à DCV. Quando associada à asma, é descrito aumento de visitas à Emergência, limitação para atividades, e prejuízo na saúde física e mental68.
A obesidade também é comorbidade comumente associada à asma. Os pacientes asmáticos obesos geralmente apresentam asma de início tardio, usam corticosteroides sistêmicos com maior frequência e apresentam inflamação não eosinofílica27,54. Estudos mostram que a obesidade está presente em mais de 50% dos pacientes com asma grave54,70. A asma associada à obesidade muitas vezes constitui um fenótipo particular de doença, que responde menos aos corticosteroides inalados, o que dificulta o seu tratamento5,54.
Ansiedade e depressão são condições que também influenciam o manejo da asma e estão relacionadas ao não controle da doença70. No estudo U-BIOPRED os pacientes com asma grave apresentaram altos níveis de ansiedade e depressão quando comparados aos que tinham doença mais leve58. Estudo recente documentou que 38% dos pacientes com asma grave apresentavam sintomas de ansiedade, e 25% de depressão71, o que reforça a importância dessas comorbidades nesse perfil de pacientes.
Na avaliação do paciente com asma grave também devem ser consideradas outras doenças relacionadas aos pulmões, que podem estar associadas ou mimetizar a asma, como DPOC, aspergilose broncopulmonar alérgica (ABPA), bronquiectasia, e granulomatose eosinofilica com poliangeíte (GEPA).
O diagnóstico de DPOC é definido pela história de tabagismo ou exposição à queima de biomassa e espirometria com obstrução persistente ao fluxo aéreo caracterizada por relação VEF1/CVF abaixo de 0,7072. A asma pode ser um fator de risco para limitação irreversível ao fluxo aéreo e DPOC72. Pacientes com ACO apresentam maior número de exacerbações, e são definidos como aqueles que têm histórico de asma e tabagismo ou exposição à biomassa e apresentam obstrução fixa do fluxo aéreo73.
A ABPA deve ser considerada em todos os pacientes com asma cuja doença se apresenta de forma mais grave. Para o diagnóstico de ABPA devem estar presentes todos os seguintes critérios: asma, IgE total acima de 1.000 UI/mL, teste cutâneo de puntura positivo ou IgE específica para Aspergillus fumigatus (Af), IgG específica para Af ou precipitinas para Af positivas74. Eosinofilia periférica e bronquiectasias também podem estar presentes74.
A prevalência de bronquiectasia é alta na asma grave, e são descritas em até 40% dos pacientes75. Os pacientes asmáticos com bronquiectasias têm mais exacerbações e hospitalizações. Na presença de bronquiectasias, outras doenças que cursam com sintomas respiratórios devem ser pesquisadas, como a fibrose cística e as imunodeficiências primárias, sendo recomendada a realização de exames para exclusão53.
Outra doença pouco comum, que deve ser considerada nos pacientes que não alcançam o controle da asma, é a GEPA. Essa doença era conhecida como síndrome de Churg Strauss, e caracteriza-se por vasculite que afeta pequenos e médios vasos, é associada a eosinofilia e frequentemente acomete o sistema respiratório. A doença apresenta três fases distintas, e na primeira, que pode durar anos, os achados são de RSC com polipose nasal e asma. Quanto ao diagnóstico, apenas 40% dos pacientes apresentam anticorpos contra citoplasma de neutrófilos (ANCA) positivos76. Pode ocorrer envolvimento de diversos órgãos, e o diagnóstico é confirmado por biopsia com evidência de vasculite76.
Fenótipos de asma
A asma é uma doença heterogênea com distintos mecanismos. Suas características demográficas, clínicas, funcionais, e/ou etiopatogênicas reconhecidas e agrupadas são denominadas fenótipos. Diversos fenótipos foram identificados na asma, sendo os mais comuns: asma alérgica, não alérgica, de início tardio, a associada à obesidade e a com obstrução fixa ao fluxo aéreo1.
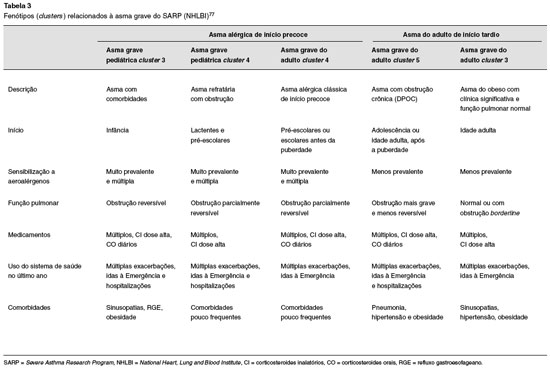
O National Heart, Lung and Blood Institute's Severe Asthma Research Program (SARP) caracterizou e agrupou determinados fenótipos (clusters) presentes na asma. Os grupos de fenótipos relacionados à asma grave estão descritos na Tabela 377.
A GINA, para asma de difícil controle e asma grave, destaca dois fenótipos relacionados à asma grave, de acordo com o seu padrão inflamatório: o tipo 2 e o não tipo 2. Já outros autores consideram esta divisão de fato como endotipos de asma, pois seria baseada nos seus mecanismos imunológicos e em biomarcadores25,78-80.
A inflamação tipo 2 está presente em cerca de 50% dos casos de asma grave. Tem participação das citocinas IL4, IL5 e IL13 relacionadas à resposta imune adaptativa aos alérgenos. Tanto as células Th2 e ILC2 (linfoide inata) produzem estas citocinas e são reguladas pelo fator de transcrição GATA-3. Também pode ser desencadeada por vírus, bactérias, e irritantes pelo estímulo do sistema de imunidade inata, via a produção de IL33. A IL25, IL33 e TSLP (linfopoietina estromal tímica) são mediadores epiteliais que regulam a expressão das citocinas do tipo 225,78,79,81.
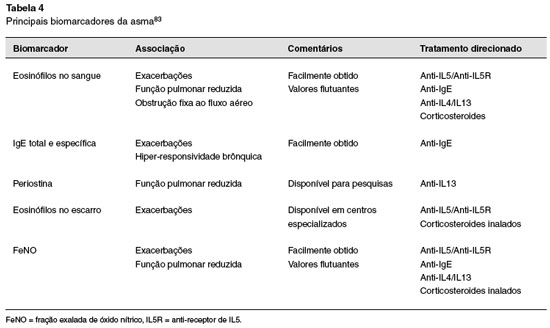
O fenótipo inflamatório tipo 2 é na maior parte das vezes eosinofílico, e pode estar ou não associado à atopia. Podemos observar eosinófilos aumentados tanto no sangue como no escarro, e se ambos estiverem elevados, teríamos uma relação com maior risco de exacerbações25,78,79.
Outro biomarcador da inflamação tipo 2 é a concentração de óxido nítrico exalado (FeNO). Seus valores normais são inferiores a 25 ppb. FeNO inicialmente elevado sugere possível benefício clínico com o uso de CI. Se após o tratamento com estes medicamentos os valores ficarem iguais ou maiores que 50 ppb, resistência aos corticosteroides ou não adesão ao tratamento devem ser considerados. Níveis elevados de FeNO (≥ 50 ppb) também se relacionam com o maior risco de exacerbações na asma79,81,82.
Além do FeNO, a periostina sérica também reflete a inflamação tipo 2. A periostina é produzida pelas células epiteliais pulmonares e fibroblastos em resposta à IL1379,82. Por fim, temos a IgE total e a específica, que também são importantes biomarcadores associados à inflamação tipo 2 na asma, que se relaciona com a sensibilização alérgica e são frequentemente utilizadas na caracterização deste fenótipo79,82. A Tabela 4 resume os principais biomarcadores, associações e possibilidades terapêuticas correlatas83.
Indivíduos com asma de fenótipo inflamatório do tipo 2 tendem a ter melhor resposta aos corticosteroides, mas com desfechos variáveis. Os casos refratários aos CI podem responder aos CO ou a outros tratamentos, como os biológicos (terapia-alvo) específicos para este padrão de inflamação25,81.
A inflamação tipo 2 refratária seria caracterizada, em pacientes utilizando elevadas doses de CI, por:
– eosinofilia sérica ≥ 150/µL e/ou;
– FeNO ≥ 20 ppb e/ou;
– eosinofilia no escarro ≥ 2% e/ou;
– sintomas de asma associados à exposição a alérgenos.
Estes achados já são indicativos de elegibilidade para o uso dos medicamentos biológicos25.
A patogenia da inflamação não tipo 2 é caracterizada pela ausência de marcadores deste tipo de resposta, como a eosinofilia, e com a presença de neutrofilia ou inflamação paucicelular, decorrentes da ativação de células Th1 e/ou Th17, e da liberação de suas citocinas como o IFNg e a IL17. Outras citocinas também podem estar envolvidas na sua patogênese, como TNFa, IL1b, IL6, IL8 e IL12. Asmáticos não tipo 2 geralmente têm asma de início tardio, não têm antecedentes de alergias, e são menos responsivos aos corticosteroides25,78,79,81.
Opções terapêuticas
A GINA propõe um fluxograma para o manejo de pacientes com asma de difícil controle e asma grave. Uma versão adaptada deste fluxograma é descrita na Figura 1.

Figura 1 Fluxograma para o manejo de pacientes com Asma de difícil controle e Asma grave (adaptação do GINA25)
LABA = agente beta 2-agonista de longa duração, CI = corticosteroide inalatório, CO - corticosteroide oral.
Considerações adicionais
a. Macrolídeos
Os macrolídeos podem ser benéficos na asma, apesar da sua administração poder aumentar o risco de resistência microbiana. Eles alcançam sua ação por diferentes mecanismos, principalmente relacionados a efeitos anti-inflamatórios ou inibitórios sobre o microbioma das vias aéreas. Estudos avaliaram seus efeitos clínicos na asma grave com resultados positivos, principalmente em pacientes com asma não eosinofílica, com redução de exacerbações e melhora da qualidade de vida destes pacientes. Esquemas com azitromicina 250 mg ou 500 mg diários por cinco dias, e posteriormente três vezes na semana, por um período de três meses, podem ser utilizados84.
b. Termoplastia brônquica
É um procedimento broncofibroscópico onde o calor gerado por radiofrequência é aplicado na árvore brônquica, reduzindo o volume de músculo liso das vias aéreas, diminuindo a sua capacidade de broncoconstrição, e levando a melhor controle da asma. Em ensaios clínicos randomizados, a termoplastia brônquica melhorou os sintomas da asma, reduziu exacerbações e melhorou a qualidade de vida por um longo prazo (até 5 anos). A termoplastia brônquica pode levar, no período peritratamento, a agudizações da asma e a necessidade de hospitalizações, mas após seis semanas do procedimento já se observa diminuição destas em relação ao período anterior ao procedimento. Outras complicações menos frequentes são pneumonias e atelectasias. A termoplastia brônquica pode ser uma opção para pacientes com asma não tipo 2, não controlada por medicamentos83,84.
Corticosteroide inalado em altas doses
a. Quando aumentar a dose
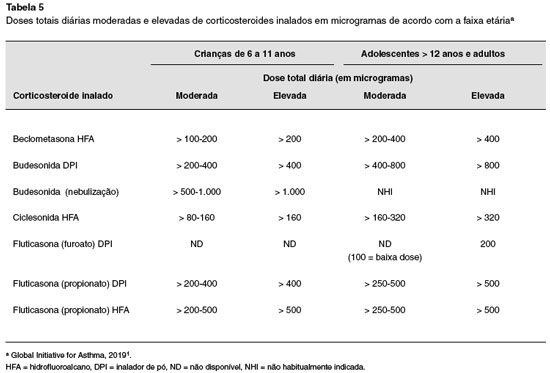
Em linhas gerais, recomenda-se aumentar a dose do CI até que o controle da asma seja alcançado1. Outros aspectos do tratamento, como adesão, técnica inalatória e controle de comorbidades devem sempre ser considerados antes de passar à próxima etapa do tratamento. As doses de CI consideradas altas variam com a idade, com o dispositivo empregado e com a molécula de corticosteroide empregada. Os limites de doses variam entre os consensos. Em adultos, doses superiores a 500 μg de propionato de fluticasona (inalador de pó ou aerossol dosimetrado) são consideradas elevadas pela GINA1 e pelo Consenso Britânico83, enquanto doses de 1.000 μg ou superiores são consideradas elevadas pelo consenso de asma grave da ATS/ERS5. Há grande variabilidade individual na resposta às diferentes doses de CI, e há evidências de que alguns pacientes podem se beneficiar de doses superiores às usualmente preconizadas, inclusive com algum efeito poupador de CO5. É importante ressaltar que a curva dose-resposta aos CI se torna achatada à medida que aumentamos a dose, o que significa que o aumento da dose não significa aumento do benefício clínico85 e, nos casos de uso de doses muito elevadas, deve-se monitorar possíveis efeitos adversos sistêmicos. Na última atualização da GINA1, as doses dos CI estão classificadas conforme a Tabela 5.
b. Por quanto tempo usar corticosteroide inalado em dose alta
As recomendações gerais do tratamento da asma preconizam reavaliação rotineira do esquema de tratamento farmacológico a cada três ou quatro meses. Doses altas de CI devem ser empregadas pelo menor tempo necessário, e deve-se buscar a menor dose suficiente para manutenção do controle da doença e redução do risco de exacerbações85. A possibilidade de eventos adversos sistêmicos aumenta com o uso prolongado de altas doses de CI, e tais efeitos, como supressão do eixo hipotálamo-hipófise-adrenal, redução da velocidade de crescimento, estimulação da absorção óssea aumentando o risco de osteopenia/osteoporose, aumento da pressão ocular e desenvolvimento de catarata subcapsular, devem ser monitorizados86,87.
Quando indicar o uso de tiotrópio
O tiotrópio é um antagonista do receptor muscarínico de longa ação (LAMA) incorporado nas diretrizes de tratamento da GINA desde 2015 como uma terapia alternativa. Na atualização de 2019, o tiotrópio está indicado para crianças com 6 anos de idade ou mais, adolescentes e adultos nas etapas 4 e 5 do tratamento. No Brasil, também está aprovado para uso a partir dos seis anos de idade. Está indicado para pacientes que não estão bem controlados ou apresentam exacerbações apesar do uso da associação CI em doses moderadas ou altas com LABA1.
Revisão sistemática recentemente publicada pela Cochrane Library sobre o uso do tiotrópio adicionado à associação CI+LABA relata que os pacientes randomizados para usar o tiotrópio tiveram menor número de exacerbações em que necessitaram de CO sistêmico para controle, assim como menor número de exacerbações e tempo mais longo até a primeira exacerbação, em comparação ao grupo tratado com placebo88.
Outra revisão sistemática, desta vez em crianças com idade entre 6 e 11 anos, de três estudos com mais de 900 pacientes no total, concluiu que, no grupo que usou tiotrópio, houve aumento significativo no VEF1, menor número de pacientes com pelo menos uma exacerbação no período de observação, e melhora clinicamente relevante no controle da asma avaliada pelo questionário ACQ-789. Consistente com os achados em adultos e adolescentes, os efeitos adversos foram comparáveis aos do grupo que usou placebo. É importante ressaltar que, em um desses estudos90, os participantes estavam mal controlados a despeito do uso de CI em altas doses em combinação com LABA, ou antileucotrieno, ou em doses médias em combinação com duas drogas auxiliares. O tiotrópio pode ser importante auxiliar no controle da asma nessa população sensível aos efeitos colaterais dos CI em altas doses, em especial na velocidade do crescimento, na densidade óssea e no eixo hipotálamo-hipófise-adrenal86,87.
Agentes biológicos em uso na prática clínica e em investigação na asma
a) Aprovados
Omalizumabe (anti-IgE)
O omalizumabe é um anticorpo monoclonal humanizado da classe IgG1 com especificidade para o terceiro domínio da molécula da IgE (anti-IgE). A ação direta do omalizumabe é bloquear a ligação da IgE a seus receptores91,92. Posteriormente, outras ações indiretas foram demonstradas, como a diminuição da expressão de receptores de alta afinidade para IgE (FceRI)93, a inibição da síntese de IgE pelos linfócitos B94 e melhoria da resposta inata antiviral dependente de interferon-alfa95.
A eficácia do anticorpo anti-IgE foi comprovada, principalmente, para os desfechos taxa de exacerbações graves, qualidade de vida e redução do uso de corticosteroides sistêmicos91,92,96,97. Estudos também demonstraram diminuição de sintomas e melhora nos parâmetros da função pulmonar91,98.
Estudos abertos de pacientes com asma grave alérgica e que apresentaram mais de uma exacerbação grave nos últimos 12 meses mostraram redução de 50% a 65% na taxa de exacerbações99,100, melhora significante na qualidade de vida, e redução de 25% a 50% na dose de corticosteroide oral99,100.
Metanálise que compilou dados de sete estudos mostrou redução na taxa de exacerbações e de visitas a serviços de emergência de 38% e 47%, respectivamente101. Outra metanálise que analisou pacientes com pelo menos 52 semanas de tratamento concluiu que os efeitos benéficos da terapêutica são mantidos nos pacientes que utilizam o omalizumabe por longo prazo102. Os benefícios observados com a terapêutica adicional com anti-IgE nos pacientes com asma não controlada, apesar do uso de altas doses de corticosteroides inalados e broncodilatadores de longa duração, foram evidenciados em adultos e crianças103,104.
São apontados como possíveis preditores de boa resposta com o omalizumabe: asma de início na infância, sintomas desencadeados por alérgenos, número de eosinófilos sanguíneos ≥ 269 µL105,106 ou FeNO ≥ 20 ppb105. Os níveis basais de IgE sérica não são preditivos de reposta ao omalizumabe89.
A maioria dos pacientes respondedores o fazem em até 16 semanas de tratamento, mas outros podem demorar seis meses, ou até um ano104,105. Caso não haja resposta após este período, o omalizumabe deve ser descontinuado.
O omalizumabe tem bom perfil de segurança, mas deve ser administrado sob supervisão médica, pois raros casos de anafilaxia (0,2%) têm sido observados107,108. Não há evidências de parasitoses graves ou de difícil controle como reação adversa da terapia, apenas um estudo mostrando uma tendência de maior chance de reinfestação em quem está utilizando omalizumabe109. Também não há risco aumentado de poliangeíte granulomatosa eosinofílica110.
O omalizumabe é indicado para pacientes maiores de seis anos de vida com asma grave alérgica não responsiva ao tratamento proposto nos passos 4-5 da iniciativa GINA1,91,92. O fenótipo alérgico da asma deve ser comprovado pelos testes cutâneos de leitura imediata (epicutâneo e intradérmico) ou pela dosagem sérica de IgE específica para aeroalérgenos1,91,92.
O omalizumabe é administrado por via subcutânea, quinzenalmente ou mensalmente, de acordo com os níveis plasmáticos de IgE e o peso do paciente91,92. A dose a ser administrada também pode ser calculada pela fórmula: 0,016 mg de omalizumabe X peso (kg) X IgE total (UI/mL)111. O paciente deve permanecer sob supervisão médica por duas horas nas três primeiras administrações do anticorpo, e por meia hora nas subsequentes91.
Mepolizumabe (anti-IL5)
A IL5 é uma citocina específica envolvida no desenvolvimento e maturação dos eosinófilos, e também participa na determinação da sobrevivência destas células nos tecidos. Sua expressão está aumentada nas vias aéreas dos asmáticos e tem sido relacionada à maior gravidade da doença e com a presença de eosinofilia das vias aéreas112,113. O bloqueio terapêutico da IL5 tem sido alvo importante no tratamento da asma. Dentre os diferentes tratamentos que visam o bloqueio da IL5, o mepolizumabe e o reslizumabe objetivam impedir a ligação da IL5 ao eosinófilo, enquanto o benralizumabe tem como alvo o próprio receptor de IL5 no eosinófilo.
O mepolizumabe é um anticorpo IgG humanizado direcionado contra a IL5. Foi aprovado para o tratamento da asma grave eosinofílica, que se manifesta com aumento de eosinófilos em sangue periférico e/ou das vias aéreas, para pacientes maiores de 12 anos e, em algumas localidades como o Brasil, para maiores de 6 anos114.
O mepolizumabe é um antagonista da IL5, que se liga à molécula com alta afinidade e assim impede sua interação com o receptor de IL5 expresso em eosinófilos, inibindo sua proliferação e função. Nas primeiras 24 horas após a sua administração endovenosa, documentou-se redução de até 50% da contagem sérica inicial de eosinófilos, e que atingiu 85% entre 6 e 43 dias após o início do tratamento115,116. Comportamento semelhante observou-se com o mepolizumabe por via subcutânea117,118. Aumento dos níveis séricos de IL5 tem sido documentado com o tratamento com mepolizumabe, porém não há uma relação clara entre as concentrações de IL5, os eosinófilos no sangue e o mepolizumabe117.
Tem como indicação principal pacientes com asma grave eosinofílica refratária ao tratamento habitual (passo 4-5) e com exacerbações graves acima do esperado (duas ou mais). Estudos controlados têm documentado redução no número de exacerbações graves (até 55%) no último ano, melhora significante da qualidade de vida, assim como da função pulmonar e maior controle dos sintomas de asma119, mesmo em pacientes com eosinófilos sanguíneos acima de 150/µL.
O mepolizumabe foi a primeira terapia anti-IL5 a ser comercializada, e teve sua ação comprovada pela redução de exacerbações em pacientes asmáticos com eosinofilia periférica em até 53%120-123. Além disso, a sua adição permitiu a redução das doses basais de corticosteroide oral120. Em estudo multicêntrico de vida real em adultos, o tratamento com mepolizumabe possibilitou a redução em 50% da dose de CO ao redor da 20ª semana de tratamento, e ao final de um ano, 34% conseguiram abandonar completamente o CO121.
Quanto à segurança, os estudos DREAM, MENSA, SIRIUS e COSMOS indicam que o mepolizumabe foi bem tolerado em todas as doses. Estes ensaios principais documentaram poucos eventos adversos relacionados com a terapêutica, sugerindo segurança em curto e em longo prazo120,122-124. Apesar de ter havido relato de mortes nesses estudos, elas ocorreram de modo aleatório entre os com tratamento ativo e com placebo. De modo similar ocorreu com o relato de neoplasias. Não houve relato de anafilaxia relacionada ao mepolizumabe. O evento adverso relacionado à droga mais frequentemente apontado foi a reação local relacionada à infusão (não alérgicas) por 6% dos tratados com placebo e entre 5% e 12% dos com mepolizumabe (variável com a dose).
Recomenda-se que o tratamento com mepolizumabe seja mantido por pelo menos 4 meses, e são potenciais preditores de boa resposta: número muito elevado de eosinófilos sanguíneos125, número elevado de exacerbações graves no último ano125, asma de início tardio (adulto)126, polipose nasal127 e a necessidade de manutenção de corticosteroide oral basal127.
Embora o mepolizumabe tenha sido avaliado em ambas as formulações endovenosa e subcutânea, a sua aprovação foi para a formulação subcutânea, sendo a dose de 100 mg para maiores de 12 anos, e de 40 mg para crianças (6 a 12 anos)113, a ser administrada a cada quatro semanas.
Benralizumabe (anti-IL5R)
O benralizumabe é um anticorpo monoclonal afucosilado humanizado que se liga com alta afinidade a um epítopo dentro do domínio 1 da subunidade a do receptor da IL-5128,129. Os anticorpos monoclonais afucosilados não possuem açúcares fucose na região Fc do anticorpo, processo esse que aumenta a sua interação com o receptor de IL5 e, consequentemente, aumenta a citotoxicidade mediada por células dependentes de anticorpos (ADCC) comparada ao direcionamento do ligante IL5 diretamente130.
Essas características podem resultar em depleção mais completa de eosinófilos no lúmen das vias aéreas, sem a degranulação dos mesmos. Estudo inicial em camundongos e primatas não humanos mostrou que a administração de benralizumabe em várias doses esgotou completamente os eosinófilos no sangue periférico e nos precursores de eosinófilos na medula óssea, sem afetar outras linhagens celulares129.
Segundo a Food and Drug Administration (FDA), o benralizumabe é indicado como terapia adicional para pacientes maiores de 12 anos de idade com asma eosinofílica grave. No Brasil, a sua aprovação é para pacientes maiores de 18 anos. A aprovação para uso clínico foi baseada em três ensaios clínicos principais controlados por placebo. Dois deles avaliaram o seu efeito sobre as exacerbações da asma ao longo de 48 (SIROCCO)131 e 56 semanas (CALIMA)132. O outro avaliou a sua ação sobre a capacidade de reduzir a necessidade de corticosteroide oral ao longo de 28 semanas (ZONDA)130.
Os estudos SIROCCO e CALIMA incluíram pacientes (maiores de 12 anos) com asma eosinofílica grave tratada com doses elevadas de corticosteroide inalado associado a agente beta 2-agonista de longa duração, que estavam utilizando corticosteroide oral ou não131,132. Além disso, deveriam ter tido pelo menos duas exacerbações no ano anterior que exigiram introdução de CO ou aumento da dose em uso. Os estudos foram controlados por placebo e o benralizumabe (dose de 30 mg) foi administrado por via subcutânea a cada quatro semanas, ou a cada quatro semanas durante as primeiras três doses e em seguida, a cada oito semanas, controlado com placebo. O desfecho primário desses estudos foi a taxa de exacerbação anual ao final do tratamento.
Houve redução significante da taxa de exacerbações e melhora do VEF1 em comparação ao placebo131,132. A análise conjunta desses estudos documentou que taxas mais baixas de eosinófilos em sangue periférico (< 300 células/mm3) e ter menos que 18 anos de idade foram associados a pior resposta ao tratamento com benralizumabe130,133.
O estudo ZONDA envolveu adultos com asma grave em tratamento com doses elevadas de corticosteroide inalado associado a agente beta 2-agonista de longa duração e corticostroide oral há pelo menos seis meses130. Ao final das 28 semanas, a redução mediana da dose de corticosteroide oral foi de 75% naqueles que receberam benralizumabe (a cada 4 ou 8 semanas), em comparação a 25% para aqueles que receberam placebo. Entre os pacientes que recebiam dose diária de 12,5 mg de corticosteroide oral ou menos ao início do estudo, número maior de pacientes nos grupos benralizumabe foram capazes de interromper o tratmento com corticosteroide oral se comparados aos do grupo placebo: 56% (dose de 4 semanas) e 52% (dose de 8 semanas) versus 19% (placebo). Houve redução das taxas anuais de exacerbação da asma, no final do estudo foram de 0,83 e 0,54 para os tratados com benralizumabe, e 1,83 nos que receberam placebo. Melhora nos valores de VEF1 foram maiores com o benralizumabe, do que com o placebo por 20 semanas, mas não à 28ª semana de tratamento130.
Os eventos adversos mais comuns com benralizumabe nesses estudos de exacerbação incluíram cefaleia (8,6%), faringite (4%), artralgia (3,9%) e tosse (3,3%). Todos eles ocorreram com mais frequência com benralizumabe do que com placebo. Reações no local da injeção foram relatadas em 2,2% daqueles tratados por oito semanas, e 1,9% dos tratados com placebo. Reações de hipersensibilidade, como urticária e erupção cutânea, foram ocasionalmente relatadas com benralizumabe131,132. É descrito o desenvolvimento de anticorpos ao benralizumabe por 13% dos pacientes, sem, no entanto, afetar a eficácia ou a segurança131,132.
Por reduzir o número de eosinófilos, o benralizumabe poderia prejudicar a resposta imunitária às infecções por helmintos. As infecções pré-existentes devem ser tratadas antes do início da terapia. Em casos de desenvolvimento de infecção por helmintos durante a terapia, não responsiva aos anti-helmínticos, o benralizumabe deve ser interrompido131-135.
O benralizumabe é apresentado em seringa pré-montada de dose única (30 mg). A dose recomendada (uma seringa) deve ser administrada por via subcutânea (parte superior do braço, coxa ou abdomen) por um profissional de saúde, a cada quatro semanas, durante as primeiras três doses e, em seguida, a cada oito semanas134.
A sua meia-vida de eliminação é de cerca de 15,5 dias, e por ser totalmente catabolizado, não se espera que haja interferência da sua metabolização e eliminação em indivíduos com insuficiência renal ou hepática134,135. Embora não tenha sido avaliado em gestantes, os anticorpos IgG podem atravessar a placenta particularmente no terceiro trimestre da gravidez. Isso poderia esgotar os eosinófilos no feto e apresentar riscos ao recém-nascido. Anticorpos também podem ser excretados no leite materno134.
Reslizumabe
Reslizumabe é anticorpo monoclonal humanizado subtipo IgG4 contra a IL5 humana, citocina chave na diferenciação, maturação, recrutamento e ativação de eosinófilos humanos. Por se ligar à IL5, bloqueia a sua função biológica, com consequente redução da atividade e sobrevida dos eosinófilos. A sua administração endovenosa, na dose de 3 mg/kg a cada três semanas, é seguida por queda do número de eosinófilos circulantes e, portanto, tem como principal indicação a asma grave eosinofílica não controlada136.
Estudos iniciais em pacientes com asma grave esosinofílica não controlada identificaram ser a taxa de eosinófilos sanguíneos ≥ 400 células/mm3 o ponto de corte para a obtenção de melhores resultados clínicos. A análise comparativa com o mepolizumabe mostrou que ambos reduziram de modo significante, mas não diferente, as exacerbações de asma137. Houve também incremento do VEF1 significantemente maior do que o observado com placebo138. Esse fato não ocorreu entre os com eosinofilia sanguínea abaixo daquele índice.
Revisão sistemática seguida por metanálise avaliou cinco estudos randomizados e controlados por placebo de pacientes com asma grave eosinofílica para avaliar a eficácia do tratamento com reslizumabe ou mepolizumabe139. A análise combinada dos cinco estudos que avaliaram 2.197 pacientes documentou redução significante de 53% no número de exacerbações anuais de asma entre os tratados com anti IL5 comparados ao placebo139. Dois estudos compararam o reslizumabe em 953 pacientes e documentaram risco relativo de exacerbação anual de asma significantemente menor quando comparado ao placebo (RR = 0,46; IC95%: 0,37-0,59; p < 0,001), assim como do número de pacientes que não tiveram exacerbação alguma (RR = 1,36; IC95%: 1,22 a 1,52; p < 0,01)143. Não há estudos que avaliaram a capacidade poupadora de corticosteroide oral entre os pacientes tratados com reslizumabe30.
Estudo multicêntrico, prospectivo, aberto, de grupo único, avaliou a ação do reslizumabe em pacientes com asma eosinofílica grave não responsiva ao tratamento com omalizumabe139. Houve incremento do escore de ACT de 13 para 21 na 24ª semana de tratamento. Dois pacientes tiveram pelo menos uma exacerbação grave de asma, e nove precisaram ser hospitalizados139. De maneira geral, 15/25 (60%) pacientes foram considerados controlados (ACT ≥ 20 e sem exacerbações) na 24ª semana de tratamento. O percentual de pacientes necessitando corticosteroide oral diariamente reduziu significantemente de 72% a 52% (p = 0,019)140. Os eventos adversos foram de média intensidade e com incidência similar à descrita previamente para reslizumabe140.
O reslizumabe, aprovado pela FDA para uso em pacientes com 18 anos ou mais com asma grave eosinofílica não controlada, já está aprovado para uso no Brasil para a mesma faixa etária.
b) Ainda não aprovados
Dupilumabe (anti-IL4/IL13)
O dupilumabe é um anticorpo monoclonal IgG4 totalmente humano e direcionado contra a subunidade alfa do receptor de IL4 e que bloqueia a sinalização intracelular da IL4 e IL13141. Estas citocinas são chave na ativação de resposta inflamatória tipo 2 e importantes na patogênese das doenças alérgicas. A IL4 induz a diferenciação de células CD4+ naive em células Th2 efetoras. A IL13 é importante na metaplasia de células globosas, hipersecreção de muco e sobre o músculo liso142.
Inicialmente aprovado pela FDA para o uso em adultos com dermatite atópica grave, foi recentemente liberado para pacientes maiores de 12 anos com dermatite atópica moderada/grave não controlada ou asma moderada/grave não controlada143,144 e para rinossinusite crônica com polipose nasal. No Brasil, há apenas a aprovação para uso em dermatite atópica moderada/grave145. É o primeiro imunobiológico que pode ser autoadministrado pelo paciente.
A ação benéfica do dupilumabe, comparado a placebo em pacientes com asma grave foi avaliada por revisão sistemática seguida por metanálise de quatro estudos clínicos randomizados em pacientes maiores de 18 anos com asma grave não controlada146. Foi observada redução significante nas exacerbações de asma no grupo tratado com dupilumabe em comparação com placebo, com taxas anuais de exacerbação de 13% e 27%, respectivamente (RR = 0,44; IC95%: 0,35-0,55; p < 0,01) e aumento significante nos valores do VEF1 no grupo dupilumabe quando comparado ao placebo (diferença média = 0,14L; IC95%: 0,12-0,17; p < 0,01)146. Considerando-se o número de eosinófilos ao início do tratamento, não houve interferência sobre essa variável. Não houve diferenças significantes entre os dois grupos quanto a apresentar pelo menos um evento adverso, evento adverso grave, evento adverso capaz de levar à morte, descontinuação da medicação por evento adverso, ocorrência de infecção de vias aéreas superiores, influenza e bronquite infecciosa146. O tratamento com dupilumabe foi associado a risco aumentado de reações no local da sua aplicação (RR = 1,91; IC95%: 1,41-2,59; p < 0,01)146. De modo similar aos estudos incluídos nessa metanálise, concluiu-se que a pacientes com asma grave não controlada a adição do dupilumabe foi associada a risco reduzido de exacerbações graves de asma, melhora do VEF1 sem haver aumento de eventos adversos, exceto pela reação no local da injeção com dupilumabe136,146.
Lebrikizumabe (anti-IL13)
A IL13, citocina associada à resposta inflamatória Th2, exerce papel importante na patofisiologia da asma por atuar no recrutamento de eosinófilos e basófilos, na produção de muco, diferenciação de células globosas e na produção de IgE147. A IL13 induz as células epiteliais brônquicas a secretarem periostina, que pode ser detectada no soro. A periostina é expressa de modo intenso nos pulmões de pacientes com asma e contribui para a secreção de muco, fibrose e remodelamento das vias aéreas148. A periostina tem sido identificada como biomarcador da inflamação Th2 na asma149.
Vários anticorpos monoclonais humanizados anti-IL13 estão sob avaliação clínica, são eles: anrukinzumabe, lebrikizumabe e o tralokinumabe150.
Estudos iniciais, randômicos e controlados, mostraram resultados promissores no tratamento de pacientes com asma grave não controlada com anti-IL13. Revisão sistemática de cinco estudos randômicos controlados por placebo seguida por metanálise avaliou a eficácia e a segurança do lebrikizumabe no tratamento de adultos com asma grave não controlada com dose elevada de CI associada a LABA151. Foram avaliados cerca de 1.900 pacientes e documentou-se redução significante na taxa de exacerbações de asma e aumento significante do VEF1 previsto (p < 0,0003). A análise após estratificação segundo os níveis de periostina mostrou que o tratamento ativo naqueles com valores elevados aumentou significantemente a função pulmonar (p < 0,0009), fato que não ocorreu entre os com níveis baixos. Não houve diferenças entre os tratados com lebrikizumabe e placebo com relação à incidência de eventos adversos.
Esses efeitos foram corroborados por metanálise recente que avaliou o tratamento de adultos com asma grave não controlada com anti IL13: lebrikizumabe e tralokinumabe. O tratamento ativo acompanhou-se por redução significante das exacerbações da asma, do VEF1, redução do uso de medicação de resgate, melhora da qualidade de vida sem aumento da incidência de eventos adversos e os graves. A periostina também foi confirmada como bom biomarcador para detectar um grupo específico de pacientes que podem se beneficiar com o tratamento com anti IL13150.
O lebrikizumabe, assim como o tralokizumabe, não estão disponíveis para uso no Brasil.
Altrakincept (anti-IL4)
Altrakincept é um análogo recombinante humano solúvel do receptor da IL4 (IL4R) à porção extracelular da cadeia alfa do receptor de IL4, e bloqueia a ligação da IL4 aos IL4R presentes na membrana celular151.
Estudos iniciais mostraram ser os IL4R solúveis seguros e bem tolerados. Em estudos em pacientes com asma moderada, o altrakincept manteve a função pulmonar após a remoção de corticosteroide inalado152, fato não confirmado por estudos posteriores153. Não está disponível para uso no Brasil.
Tezepelumabe (anti-TSLP)
O tezepelumabe (AMG 157/MEDI9929) é anticorpo monoclonal humanizado específico contra a citocina derivada de células epiteliais, a linfopoietina do estroma tímico (TSLP), indicado para pacientes com asma moderada a grave, sobretudo os com inflamação não eosinofílica154.
Estudo de fase 2, duplo-cego controlado por placebo, avaliou o tezepelumabe subcutâneo em três doses contra placebo por 52 semanas em adultos com asma moderada/grave não controlada com dose média/alta de corticosteroide e LABA inalados. O objetivo principal primário foi o número de exacerbações anuais na 52ª semana de tratamento. Independentemente da dose empregada (baixa, média, alta), houve redução significante da taxa anual de exacerbações de asma (média 66%) quando comparado ao placebo, isto independentemente do número de eosinófilos ao início do estudo. Os valores de VEF1 pré-broncodilatador na 52ª semana de tratamento foram significantemente maiores que o do placebo para os três regimes de tratamento154.
Fevipiprante (QAW039)
Fevipiprante é uma molécula homóloga à do receptor quimioatraente ligado à proteína G e expresso em células Th2 (CRTH2). É um inibidor oral, altamente seletivo, potente, e antagonista reversível competititvo da CRTH2155.
Estudos iniciais demonstraram segurança e eficácia do fevipiprante em pacientes com asma, especificamente aumento do VEF1 e redução da inflamação eosinofílica da via aérea. Ainda se desconhece qual seria o melhor biomarcador capaz de prever resposta favorável ao fevipiprante, embora a resposta de pacientes com asma moderada a grave e evidência de inflamação Th2 parece reunir os melhores respondedores155,156.
Vários estudos clínicos de fase III (LUSTER 1 e 2) estão avaliando a segurança do fevipiprante, assim como seu efeito sobre as exacerbações de asma em pacientes com doença grave não controlada. Os estudos ZEAL 1 e 2 avaliam a eficácia e a segurança do fevipiprante em pacientes com asma moderada e não controlada apesar do uso de corticosteroide inalado. Outros antagonistas de receptores de CRTH2 estão sob estudo: AZD1981, OC000459, setipiprante e BI671800155,156.
Além dos anteriormente mencionados, outros agentes estão ainda em estudo: anti-CXCR2/IL8, anti-IL33, anti-IL25, anti-IL17, entre outros158.
REFERÊNCIAS
1. Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention, 2019. Disponível em: www.ginasthma.org. Acesso em: 27/08/2019.
2. Carr TF, Bleecker E. Asthma heterogeneity and severity. World Allergy Organ J. 2016;9(1):41.
3. Ullmann N, Mirra V, Di Marco A, Pavone M, Porcaro F, Negro V, et al. Asthma: Differential Diagnosis and Comorbidities. Front Pediatr. 2018;6:276.
4. Aaron SD, Vandemheen KL, FitzGerald JM, Ainslie M, Gupta S, Lemière C, et al. Reevaluation of diagnosis in adults with physician-diagnosed asthma. JAMA. 2017;317(3):269-79.
5. Chung KF, Wenzel SE, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2014;43:343-73.
6. FitzGerald JM, Lemiere C, Lougheed MD, Ducharme FM, Dell SD, Ramsey C, et al. Recognition and management of severe asthma: A Canadian Thoracic Society position statement, Can J Respi Crit Care Sleep Med. 2017;1:199-221.
7. Bousquet J, Mantzouranis E, Cruz AA, Aït-Khaled N, Baena-Cagnani CE, Bleecker ER, et al. Uniform definition of asthma severity, control, and exacerbations: document presented for the World Health Organization Consultation on Severe Asthma. J Allergy Clin Immunol. 2010;126(5):926-38.
8. Chung KF, Wenzel S, Brozek JL, Bush A, Castro M, Sterk PJ, et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J. 2018 Jul 27;52(1). pii: 1352020. doi: 10.1183/13993003.52020-2013.
9. Souza-Machado A, Cavalcanti M, Cruz AA. Má percepção da limitação aos fluxos aéreos em pacientes com asma moderada a grave. J Bras Pneumol. 2001;27(4):185-92.
10. Fernandes AGO, Souza-Machado C, Coelho RCP. Fatores de risco de morte em portadores de asma grave J Bras Pneumol. 2014;40(4):364-72.
11. Juniper EF, O'Byrne PM, Guyatt GH, Ferrie PJ, King DR. Development and validation of a questionnaire to measure asthma control. Eur Respir J. 1999;14:902-7.
12. Boulet LP, Boulet V, Milot J. How should we quantify asthma control? A proposal. Chest. 2002;122:2217-23.
13. Nathan RA, Sorkness CA, Kosinski M, Schatz M, Li JT, Marcus P, et al. Development of the asthma control test: A survey for assessing asthma control. J Allergy Clin Immunol. 2004;113:59-65.
14. LeBlanc A, Robichaud P, Lacasse Y, Boulet LP. Quantification of asthma control: validation of the Asthma Control Scoring System. Allergy. 2007;62(2):120-5.
15. Liu AH, Zeiger R, Sorkness C, Mahr T, Ostrom N, Burgess S, et al. Development and cross-sectional validation of the Childhood Asthma Control Test. J Allergy Clin Immunol. 2007;119(4):817-25.
16. Kim H, Ellis AK, Fischer D, Noseworthy M, Olivenstein R, Chapman KR, et al. Asthma biomarkers in the age of biologics. Allergy Asthma Clin Immunol. 2017;13:48.
17. Korn SL, Both J, Jung M, Hübner M, Taube C, Buhl R. Prospective evaluation of current asthma control using ACQ and ACT compared with GINA criteria. Ann Allergy Asthma Immunol. 2011;107(6):474-9.
18. Roxo JPF, Ponte EV, Ramos DCB, Pimentel L, D'Oliveira Jr A, Cruz AA. Validação do Teste de Controle da Asma em português para uso no Brasil: validation for use in Brazil. J Bras Pneumol. 2010;36(2):159-66.
19. Liu AH, Zeiger RS, Sorkness CA, Ostrom NK, Chipps BE, Rosa K, et al. The Childhood Asthma Control Test: retrospective determination and clinical validation of a cut point to identify children with very poorly controlled asthma. J Allergy Clin Immunol. 2010;126(2):267-73.
20. Oliveira SG, Sarria EE, Roncada C, Stein RT, Pitrez PM, Mattiello R. Validation of the Brazilian version of the childhood asthma control test (c-ACT). Pediatr Pulmonol. 2016;51(4):358-63.
21. Juniper EF, Bousquet J, Abetz L, Bateman ED. Identifying 'well-controlled' and 'not well-controlled' asthma using the Asthma Control Questionnaire. Respir Med. 2006;100:616-21.
22. Leite M, Ponte EV, Petroni J, D'Oliveira Jr A, Pizzichini E, Cruz AA. Avaliação do questionário de controle da asma validado para uso no Brasil. J Bras Pneumol. 2008:34(10):756-63.
23. Skinner EA, Diette GB, Algatt-Bergstrom PJ, Nguyen TT, Clark RD, Markson LE, et al. The Asthma Therapy Assessment Questionnaire (ATAQ) for children and adolescents. Dis Manag. 2004;7(4):305-13.
24. Tavares MGS, Pizzichini MMM, Steidle LJM, Nazário NO, Rocha CC, Perraro MC, et al . The Asthma Control Scoring System: translation and cross-cultural adaptation for use in Brazil. J Bras Pneumol. 2010;36(6):683-92.
25. Global initiative for asthma - GINA. Difficult-to-treatment severe asthma in adolescents and adult patients. Diagnosis and management 2019. Disponível em: https://ginasthma.org/wp-content/uploads/2019/04/GINA-Severe-asthma-Pocket-Guide-v2.0-wms-1.pdf. Acesso em maio de 2019.
26. Chung KF. Managing severe asthma in adults: lessons from the ERS/ATS guidelines. Curr Opin Pulm Med. 2015;21(1):8-15.
27. Tay TR, Hew M. Comorbid "treatable traits" in difficult asthma: Current evidence and clinical evaluation. Allergy. 2018;73(7):1369-82.
28. Bel EH, Sousa A, Fleming L, Bush A, Chung KF, Versnel J, et al. Diagnosis and definition of severe refractory asthma: an international consensus statement from the Innovative Medicine Initiative (IMI). Thorax. 2011;66(10):910-7.
29. von Bülow A, Backer V, Bodtger U, Søes-Petersen NU, Vest S, Steffensen I, et al. Differentiation of adult severe asthma from difficult-to-treat asthma – Outcomes of a systematic assessment protocol. Respir Med. 2018;145:41-7.
30. von Bülow A, Backer V, Bodtger U, Søes-Petersen NU, Assing KD, Skjold T, et al. The level of diagnostic assessment in severe asthma: A Nationwide real-life study. Respir Med. 2017;124:21-9.
31. Levy ML, Quanjer PH, Booker R, Cooper BG, Holmes S, Small I; General Practice Airways Group. Diagnostic spirometry in primary care: Proposed standards for general practice compliant with American Thoracic Society and European Respiratory Society recommendations: a General Practice Airways Group (GPIAG)1 document, in association with the Association for Respiratory Technology & Physiology (ARTP)2 and Education for Health3 1 www.gpiag.org 2 www.artp.org 3 www.educationforhealth.org.uk. Prim Care Respir J. 2009;18(3):130-47.
32. Radhakrishna N, Tay TR, Hore-Lacy F, Hoy R, Dabscheck E, Hew M. Profile of difficult to treat asthma patients referred for systematic assessment. Respir Med. 2016;117:166-73.
33. Freitas Ferreira E, Pascoal A, Silva P, Lourenço O, Valente S, Valente MJ, et al. Inhaler training and asthma knowledge are associated with a higher proportion of patients with correct inhaler technique in young but not in elderly asthmatic patients. J Asthma. 2019;27:1-11.
34. Melani AS, Bonavia M, Cilenti V, Cinti C, Lodi M, Martucci P, et al. Inhaler mishandling remains common in real life and is associated with reduced disease control. Respir Med. 2011;105(6):30-8.
35. Kocks JWH, Chrystyn H, van der Palen J, Thomas M, Yates L, Landis SH, et al. Systematic review of association between critical errors in inhalation and health outcomes in asthma and COPD. NPJ Prim Care Respir Med. 2018;28:43.
36. Giraud V, Roche N. Misuse of corticosteroid metered dose inhaler is associated with decreased asthma stability. Eur Respir J. 2002;19:246-51.
37. Ho SF, O'Mahony MS, Steward JA, Breay P, Burr ML. Inhaler technique in older people in the community. Age Ageing. 2004;33:185-8.
38. Coelho ACC, Souza-Machado A, Leite M, Almeida P, Castro L, Cruz CS, et al. Use of inhaler devices and asthma control in severe asthma patients at a referral center in the city of Salvador, Brazil. J Bras Pneumol. 2011;37:720-8.
39. Lavorini F, Magnan A, Dubus JC, Voshaar T, Corbetta L, Broeders M, et al. Effect of incorrect use of dry powder inhalers on management of patients with asthma and COPD. Respir Med. 2008;102(4):593-604.
40. Bosnic-Anticevich SZ, Sinha H, So S, Reddel HK. Metered-dose inhaler technique: the effect of two educational interventions delivered in community pharmacy over time. J Asthma. 2010;47:251-6.
41. Murphy AC, Proeschal A, Brightling CE, Wardlaw AJ, Pavord I, Bradding P, et al. The relationship between clinical outcomes and medication adherence in difficult-to-control asthma. Thorax. 2012;67(8):751-3.
42. Axelsson M, Ekerljung L, Lundbäck B. The Significance of Asthma Follow-Up Consultations for Adherence to Asthma Medication, Asthma Medication Beliefs, and Asthma Control. Nurs Res Pract. 2015:139070. doi: 10.1155/2015/139070.
43. Lin J, Yang D, Huang M, Zhang Y, Chen P, Cai S, et al. Chinese expert consensus on diagnosis and management of severe asthma. J Thorac Dis. 2018;10(12):7020-44.
44. Jeminiwa R, Hohmann L, Qian J, Garza K, Hansen R, Fox BI. Impact of eHealth on medication adherence among patients with asthma: A systematic review and meta-analysis. Respir Med. 2019;149:59-68.
45. Thomson NC, Chaudhuri R, Heaney LG, Bucknall C, Niven RM, Brightling CE, et al. Clinical outcomes and inflammatory biomarkers in current smokers and exsmokers with severe asthma. J Allergy Clin Immunol. 2013;131(4):1008-16.
46. Dolan CM, Fraher KE, Bleecker ER, Borish L, Chipps B, Hayden ML, et al. Design and baseline characteristics of The Epidemiology and Natural History of Asthma: Outcomes and Treatment Regimens (TENOR) study: a large cohort of patients with severe or difficult-to-treat asthma. Ann Allergy Asthma Immunol. 2004;92(1):32-9.
47. Heaney LG, Brightling CE, Menzies-Gow A, Stevenson M, Niven RM. British Thoracic Society Difficult Asthma Network. Refractory asthma in the UK: cross-sectional findings from a UK multicentre registry. Thorax. 2010;65:787-94.
48. To T, Stanojevic S, Moores G, Gershon AS, Bateman ED, Cruz AA, et al. Global asthma prevalence in adults: findings from the cross-sectional world health survey. BMC Public Health. 2012;12:204. doi: 10.1186/1471-2458-12-204.
49. Hoy RF, Brims F. Occupational lung diseases in Australia. Med J Aust. 2017;207(10):443-8.
50. Morales DR, Jackson C, Lipworth BJ, Donnan PT, Guthrie B. Adverse Respiratory Effect of Acute β-Blocker Exposure in Asthma. Chest. 2014;145(4),779-86.
51. Mascia K, Haselkorn T, Deniz YM, Miller DP, Bleecker ER, Borish L. Aspirin sensitivity and severity of asthma: evidence for irreversible airway obstruction in patients with severe or difficult-to-treat asthma. J Allergy Clin Immunol. 2005;116:970-5.
52. Rajan JP, Wineinger NE, Stevenson DD, White AA. Prevalence of aspirin-exacerbated respiratory disease among asthmatic patients: A meta-analysis of the literature. J Allergy Clin Immunol. 2015;135(3):676-81.
53. Gherasim A, Dao A, Bernstein JA. Confounders of severe asthma: diagnoses to consider when asthma symptoms persist despite optimal therapy. World Allergy Organ J. 2018;14;11(1):29.
54. Moore WC, Meyers DA, Wenzel SE, Teague WG, Li H, Li X, et al. Identification of asthma phenotypes using cluster analysis in the Severe Asthma Research Program. Am J Respir Crit Care Med. 2010;181(4):315-23.
55. Hekking PP, Amelink M, Wener RR, Bouvy ML, Bel EH. Comorbidities in Difficult-to-Control Asthma. J Allergy Clin Immunol Pract. 2018;6(1):108-13.
56. Tay TR, Radhakrishna N, Hore-Lacy F, Smith C, Hoy R, Dabscheck E, et al. Comorbidities in difficult asthma are independent risk factors for frequent exacerbations, poor control and diminished quality of life. Respirology. 2016;21(8):1384-90.
57. Bousquet J, Schünemann HJ, Samolinski B, Demoly P, Baena-Cagnani CE, Bachert C, ET AL. Allergic Rhinitis and its Impact on Asthma (ARIA): achievements in 10 years and future needs.J Allergy Clin Immunol. 2012;130(5):1049-62.
58. Shaw DE, Sousa AR, Fowler SJ, Fleming LJ, Roberts G, Corfield J, et al. Clinical and inflammatory characteristics of the European U-BIOPRED adult severe asthma cohort. Eur Respir J. 2015;46(5):1308-21.
59. Novelli F, Bacci E, Latorre M, Seccia V, Bartoli ML, Cianchetti S, et al. Comorbidities are associated with different features of severe asthma. Clin Mol Allergy. 2018;16:25.
60. Moore WC, Bleecker ER, Curran-Everett D, Erzurum SC, Ameredes BT, Bacharier L, et al. Characterization of the severe asthma phenotype by the National Heart, Lung, and Blood Institute's Severe Asthma Research Program. J Allergy Clin Immunol. 2007;119(2):405-13.
61. Gibson P, Henry R, Coughlan J. Gastro-oesophageal reflux treatment for asthma in adults and children (Review). Cochrane Database Syst Rev. 2003;(2):CD001496.
62. Hopper AD. Improving the diagnosis and management of GORD in adults. Practitioner. 2015;259(1781):27-32.
63. Morris MJ, Christopher KL. Diagnostic criteria for the classification of vocal cord dysfunction. Chest. 2010;138(5):1213-23.
64. Yelken K, Yilmaz A, Guven M, Eyibilen A, Aladag I. Paradoxical vocal fold motion dysfunction in asthma patients. Respirology. 2009;14(5):729-33.
65. Fretzayas A, Moustaki M, Loukou I, Douros K. Differentiating vocal cord dysfunction from asthma. J Asthma Allergy. 2017;10:277-83.
66. Davies SE, Bishopp A, Wharton S, Turner AM, Mansur AH. The association between asthma and obstructive sleep apnea (OSA): A systematic review. J Asthma. 2019 Feb;56(2):118-29.
67. Kenn K, Balkissoon R. Asthma: Vocal Cord Dysfunction (VCD) and other Dysfunctional Breathing Disorders. Sem Respir Crit Care Med. 2004;33(06):595-605.
68. Ritz T, Rosenfield D, Meuret AE, Bobb C, Steptoe A. Hyperventilation symptoms are linked to a lower perceived health in asthma patients. Ann Behav Med. 2008;35(1):97-104.
69. van Veen IH, ten Brinke A, Sterk PJ, Rabe KF, Bel EH. Airway inflammation in obese and nonobese patients with difficult-to-treat asthma. Allergy. 2008;63:570-4.
70. Ciprandi G, Schiavetti I, Rindone E, Ricciardolo FLM. The impact of anxiety and depression on outpatients with asthma. Ann Allergy Asthma Immunol. 2015;115(5):408-14.
71. McDonald VM, Hiles SA, Godbout K, Harvey ES, Marks GB, Hew M, et al. Treatable traits can be identified in a severe asthma registry and predict future exacerbations. Respirology. 2019 Jan;24(1):37-47.
72. Global initiative for lung chronic disease - GOLD. Global strategy for prevention, diagnosis and management of COPD. Updated 2019. Disponível em: https://goldcopd.org/gold-reports/. Acesso em: março/2019.
73. Boulet LP, Boulay MÈ, Dérival JL, Milot J, Lepage J, Bilodeau L, et al. Asthma-COPD Overlap Phenotypes and Smoking: Comparative features of asthma in smoking or non-smoking patients with an incomplete reversibility of airway obstruction. COPD. 2018;15(2):130-8.
74. Agarwal R, Chakrabarti A, Shah A, Gupta D, Meis JF, Guleria R, et al. Allergic bronchopulmonary aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy. 2013;43:850-73.
75. Gupta S, Siddiqui S, Haldar P, Raj JV, Entwisle JJ, Wardlaw AJ, et al. Qualitative analysis of high-resolution CT scans in severe asthma. Chest. 2009;136:1521-8.
76. Groh M, Pagnoux C, Baldini C, Bel E, Bottero P, Cottin V, et al. Eosinophilic granulomatosis with polyangiitis (Churg-Strauss) (EGPA) Consensus Task Force recommendations for evaluation and management. Eur J Int Med. 2015;26:545-53.
77. Fitzpatrick AM, Moore WC. Severe Asthma Phenotypes - How should they guide evaluation and treatment? J Allergy Clin Immunol Pract. 2017;5:901-8.
78. Charriot J, Vachier I, Halimi L, Gamez AS, Boissin C, Salama M, et al. Future treatment for asthma. Eur Respir Rev. 2016;25:77-92.
79. Tabatabaian F, Ledford DK, Casale TB. Biologic and New Therapies in Asthma. Immunol Allergy Clin N Am. 2017;37:329-43.
80. Carr TF, Kraft M. Management of Severe Asthma before Referral to the Severe Asthma Specialist. J Allergy Clin Immunol Pract. 2017;5:877-86.
81. Pepper AN, Renz H, Casale TB, Garn H. Biologic Therapy and Novel Molecular Targets of Severe Asthma. J Allergy Clin Immunol Pract. 2017;5:909-16.
82. Katial CRK, Bensch GW, Busse WW, Chipps BE, Denson JL, Gerber AN, et al. Changing Paradigms in the Treatment of Severe Asthma: The Role of Biologic Therapies. J Allergy Clin Immunol Pract. 2017;5:S1-S14.
83. The BTS/SIGN Guideline for the management of asthma 2016. [site na internet]. Disponível em: https://www.brit-thoracic.org.uk/document-library/clinical-information/asthma/btssign-asthma-guideline-2016/. Acesso em: 25/03/2019.
84. Zervas E, Samitas K, Papaioannou AI, et al. An algorithmic approach for the treatment of severe uncontrolled asthma. ERJ Open Res. 2018 Mar 6;4(1). pii: 00125-2017.
85. Martin RJ, Szefler SJ, Chinchilli VM, Kraft M, Dolovich M, Boushey HA, et al. Systemic effect comparisons of six inhaled corticosteroid preparations. Am J Respir Crit Care Med. 2002;165(10):1377-83.
86. Skoner DP. Inhaled corticosteroids. Effects on growth and bone health. Ann Allergy Asthma Immunol. 2016;117(6):595-600.
87. Carr WW, Szefler SJ. Inhaled corticosteroids: Ocular safety and the hypothalamic-pituitary-adrenal axis. Ann Allergy Asthma Immunol. 2016;117(6):589-94.
88. Kew KM, Dahri K. Long-actingmuscarinic antagonists (LAMA) added to combination long-acting beta2-agonists and inhaled corticosteroids (LABA/ICS) versus LABA/ICS for adults with asthma. Cochrane Database of Systematic Reviews 2016, Issue 1. Art. No.: CD011721.
89. Rodrigo GJ, Neffen H. Efficacy and safety of tiotropium in school-age children with moderate-to-severe symptomatic asthma: A systematic review. Pediatr Allergy Immunol. 2017;28(6):573-8.
90. Szefler SJ, Murphy K, Harper T 3rd, Boner A, Laki I, Engel M, et al. A phase III randomized controlled trial of tiotropium add-on therapy in children with severe symptomatic asthma. J Allergy Clin Immunol. 2017;140(5):1277-87.
91. Busse W, Corren J, Lanier BQ, McAlary M, Fowler-Taylor A, Cioppa GD, et al. Omalizumab, anti-IgE recombinant humanized monoclonal antibody, for the treatment of severe allergic asthma. J Allergy Clin Immunol. 2001;108(2):184-90.
92. Humbert M, Beasley R, Ayres J, Slavin R, Hébert J, Bousquet J, et al. Benefits of omalizumab as add-on therapy in patients with severe persistent asthma who are inadequately controlled despite best available therapy (GINA 2002 step 4 treatment): INNOVATE. Allergy. 2005;60(3):309-16.
93. Beck LA, Marcotte GV, MacGlashan D, Togias A, Saini S. Omalizumab-induced reductions in mast cell Fce psilon RI expression and function. J Allergy Clin Immunol. 2004;114(3):527-30.
94. Chan MA, Gigliotti NM, Dotson AL, Rosenwasser LJ. Omalizumab may decrease IgE synthesis by targeting membrane IgE+ human B cells. Clin Transl Allergy. 2013;3(1):29.
95. Teach SJ, Gill MA, Togias A, Sorkness CA, Arbes SJ Jr, Calatroni A, et al. Preseasonal treatment with either omalizumab or an inhaled corticosteroid boost to prevent fall asthma exacerbations. J Allergy Clin Immunol. 2015;136(6):1476-85.
96. Carvalho-Pinto RM, Agondi RC, Giavina-Bianchi P, Cukier A, Stelmach R. Omalizumab in patients with severe uncontrolled asthma: well-defined eligibility criteria to promote asthma control. J Bras Pneumol. 2017;43(6):487-9.
97. Karpel J, Massanari M, Geba GP, Kianifard F, Inhaber N, Zeldin RK. Effectiveness of omalizumab in reducing corticosteroid burden in patients with moderate to severe persistent allergic asthma. Ann Allergy Asthma Immunol. 2010;105(6):465-70.
98. Bhutani M, Yang WH, Hébert J, de Takacsy F, Stril JL. The real-world effect of omalizumab add on therapy for patients with moderate to severe allergic asthma: The ASTERIX Observational study. PLoS One. 2017;12(8):e0183869.
99. Brusselle G, Michils A, Louis R, Dupont L, Van de Maele B, Delobbe A, et al. "Real-life" effectiveness of omalizumab in patients with severe persistent allergic asthma: The PERSIST study. Respir Med. 2009;103(11):1633-42.
100. Humbert M, Taillé C, Mala L, Le Gros V, Just J, Molimard M, et al. Omalizumabe effectiveness in patients with severe allergic asthma according to blood eosinophil count: the STELLAIR study. Eur Respir J. 2018 May 10;51(5). pii: 1702523.
101. Bousquet J, Cabrera P, Berkman N, Buhl R, Holgate S, Wenzel S, et al. The effect of treatment with omalizumab, an anti-IgE antibody, on asthma exacerbations and emergency medical visits in patients with severe persistent asthma. Allergy. 2005;60(3):302-8.
102. Lai T, Wang S, Xu Z, Zhang C, Zhao Y, Hu Y, et al. Long-term efficacy and safety of omalizumab in patients with persistent uncontrolled allergic asthma: a systematic review and meta-analysis. Sci Rep. 2015;5:8191.
103. Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev. 2014;(1):CD003559.
104. Pitrez PM, de Souza RG, Roncada C, Heinzmann-Filho JP, Santos G, Pinto LA, et al. Impact of omalizumab in children from a middle-income country with severe therapy-resistant asthma: A real-life study. Pediatr Pulmonol. 2017;52(11):1408-13.
105. Hanania NA, Wenzel S, Rosén K, Hsieh HJ, Mosesova S, Choy DF, et al. Exploring the effects of omalizumab in allergic asthma: an analysis of biomarkers in the EXTRA study. Am J Respir Crit Care Med. 2013;187(8):804-11.
106. Casale TB, Chipps BE, Rosén K, Trzaskoma B, Haselkorn T, Omachi TA, et al. Response to omalizumab using patient enrichment criteria from trials of novel biologics in asthma. Allergy. 2018;73(2):490-7.
107. Limb SL, Starke PR, Lee CE, Chowdhury BA. Delayed onset and protracted progression of anaphylaxis after omalizumab administration in patients with asthma. J Allergy Clin Immunol. 2007;120(6):1378-81.
108. Casale TB, Luskin AT, Busse W, Zeiger RS, Trzaskoma B, Yang M, et al. Omalizumab Effectiveness by Biomarker Status in Patients with Asthma: Evidence From PROSPERO, A Prospective Real-World Study. J Allergy Clin Immunol Pract. 2019;7(1):156-64.
109. Cruz AA, Lima F, Sarinho E, Ayre G, Martin C, Fox H, et al. Safety of anti-immunoglobulin E therapy with omalizumab in allergic patients at risk of geohelminth infection. Clin Exp Allergy. 2007;37(2):197-207.
110. Giavina-Bianchi P, Giavina-Bianchi M, Agondi R, Kalil J. Administration of anti-IgE to a Churg-Strauss syndrome patient. Int Arch Allergy Immunol. 2007;144(2):155-8.
111. Rambasek T, Kavuru MS. Omalizumab dosing via the recommended card versus use of the published formula. J Allergy Clin Immunol. 2006;117(3):708-9.
112. Menzies-Gow A, Robinson DS. Eosinophils, eosinophilic cytokines (interleukin-5), and antieosinophilic therapy in asthma. Curr Opin Pulm Med. 2002;8:33-8.
113. Robinson DS, Ying S, Bentley AM, Meng Q, North J, Durham SR, et al. Relationships among numbers of bronchoalveolar lavage cells expressing messenger ribonucleic acid for cytokines, asthma symptoms, and airway methacholine responsiveness in atopic asthma. J Allergy Clin Immunol. 1993;92:397-403.
114. Nucala (mepolizumabe) - Nova indicação. Disponível em: http://portal.anvisa.gov.br/informacoes-tecnicas13?p_p_id=101_INSTANCE_WvKKx2fhdjM2&p_p_col_id=column-2&p_p_col_pos=1&p_p_col_count=2&_101_INSTANCE_WvKKx2fhdjM2_groupId=219201&_101_INSTANCE_
WvKKx2fhdjM2_urlTitle=nucala-mepolizumabe-&_101_INSTANCE_WvKKx2fhdjM2_struts_action=%2Fasset_publisher%2Fview_content&_
101_INSTANCE_WvKKx2fhdjM2_assetEntryId=5584341&_101_INSTANCE_WvKKx2fhdjM2_type=content. Acesso em agosto de 2019.
115. Smith DA, Minthorn EA, Beerahee M, Carolina N. Pharmacokinetics and pharmacodynamics of mepolizumab, an anti-Interleukin-5 monoclonal antibody. Clin Pharmacokinet. 2011;50:215-27.
116. Tsukamoto N, Takahashi N, Itoh H, Pouliquen I. Pharmacokinetics and pharmacodynamics of mepolizumab, an anti-interleukin 5 monoclonal antibody, in healthy Japanese male subjects. Clin Pharmacol Drug Dev. 2016;5:102-8.
117. Pouliquen IJ, Kornmann O, Barton SV, Price JA, Ortega HG. Characterization of the relationship between dose and blood eosinophil response following subcutaneous administration of mepolizumab. Int J Clin Pharmacol Ther. 2015;53:1015-27.
118. Flood-Page PT, Menzies-Gow AN, Kay AB, Robinson DS. Eosinophil's role remains uncertain as anti-interleukin-5 only partially depletes numbers in asthmatic airway. Am J Respir Crit Care Med. 2003;167:199-204.
119. Farne HA, Wilson A, Powell C, Bax L, Milan SJ. Anti-IL5 therapies for asthma. Cochrane Database Syst Rev. 2017;9:CD010834.
120. Pavord ID, Korn S, Howarth P, Bleecker ER, Buhl R, Keene ON, et al. Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial. Lancet (London, England). 2012;380:651-9.
121. Harrison T, Canonica GW, Gemzoe K, Maxwell A, Yang S, Joksaite S, et al. Effectiveness and safety in real-world clinical practice: the REALITI-A study. ERS International Congress 2019, Madrid, Abs-2104.
122. Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A, et al. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med. 2014;371:1198-207.
123. Lugogo N, Domingo C, Chanez P, Leigh R, Gilson MJ, Price RG, et al. Long-term efficacy and safety of mepolizumab in patients with severe eosinophilic asthma: a multi-center, openlabel, Phase IIIb study. Clin Ther. 2016:1-14.
124. Bel EH, Wenzel SE, Thompson PJ, Prazma CM, Keene ON, Yancey SW, et al. Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma. N Engl J Med. 2014;371:1189-97.
125. Ortega HG, Yancey SW, Mayer B, Gunsoy NB, Keene ON, Bleecker ER, et al. Severe eosinophilic asthma treated with mepolizumab stratified by baseline eosinophil thresholds: a secondary analysis of the DREAM and MENSA studies. Lancet Respir Med. 2016;4(7):549-56.
126. Brusselle G, Germinaro M, Weiss S, Zangrilli J. Reslizumab in patients with inadequately controlled late-onset asthma and elevated blood eosinophils. Pulm Pharmacol Ther. 2017;43:39-45.
127. FitzGerald JM, Bleecker ER, Menzies-Gow A, Zangrilli JG, Hirsch I, Metcalfe P, et al. Predictors of enhanced response with benralizumab for patients with severe asthma: pooled analysis of the SIROCCO and CALIMA studies. Lancet Respir Med. 2018;6(1):51-64.
128. Koike M, Nakamura K, Furuya A, Iida A, Anazawa H, Takatsu K, et al. Establishment of humanized anti-interleukin-5 receptor alpha chain monoclonal antibodies having a potent neutralizing activity. Hum Antibodies. 2009;18(1-2):17-27.
129. Kolbeck R, Kozhich A, Koike M, Peng L, Andersson CK, Damschroder MM, et al. MEDI-563, a humanized anti-IL-5 receptor alpha mAb with enhanced antibody-dependent cell- mediated cytotoxicity function. J Allergy Clin Immunol. 2010;125(6):1344-53.
130. Nair P, Wenzel S, Rabe KF, Bourdin A, Lugogo NL, Kuna P, et al. Oral glucocorticoid-sparing effect of benralizumab in severe asthma. N Engl J Med. 2017;375:2448-58.
131. Bleeker ER, FitzGerald JM, Chanez P, Papi A, Weinstein SF, Barker P, et al. Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting β-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial. Lancet. 2016;388:2115-27.
132. FitzGerald JM, Bleecker ER, Nair P, Korn S, Ohta K, Lommatzsch M, et al. Benralizumab, an anti-interleukin-5 receptor a monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomized, double-blind, placebo-controlled phase 3 trial. Lancet. 2016;388:2128-41.
133. FitzGerald JM, Bleeker ER, Menzies-Gow A, Zangrilli JG, Hirsch I, Metcalfe P, et al. Predictors of enhanced response with benralizumab for patients with severe asthma: pooled analysis of the SIROCCO and CALIMA studies. Lancet Respir Med. 2018;6:51-64.
134. Busse WW, Bleecker ER, FitzGerald JM, Ferguson GT, Barker P, Sproule S, et al. Long-term safety and efficacy of benralizumab in patients with severe, uncontrolled asthma: 1-year results from the BORA phase 3 extension trial. Lancet Respir Med. 2019;7:46-59.
135. Khorasanizadeh M, Eskian M, Assa'ad AH, Camargo CA Jr, Rezaei N. Efficacy and Safety of Benralizumab, a Monoclonal Antibody against IL-5Rα, in Uncontrolled Eosinophilic Asthma. Int Rev Immunol. 2016;35(4):294-311.
136. Busse WW. Biological treatments for severe asthma: A major advance in asthma care. Allergol Int. 2019 Apr;68(2):158-66.
137. Castro M, Zangrilli J, Wechsler ME, Bateman ED, Brusselle GG, Bardin P, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomized, placebo-controlled, phase 3 trials. Lancet Respir Med. 2015;3:355e66.
138. Corren J, Weinstein S, Janka L, Zangrilli J, Garin M. Phase 3 study of reslizumab in patients with poorly controlled asthma: effects across a broad range of eosinophil counts. Chest. 2016;150:799e810.
139. Henriksen DP, Bodtger U, Sidenius K, Maltbaek N, Pedersen L, Madsen H, et al. Efficacy, adverse events, and inter-drug comparison of mepolizumab and reslizumab anti-IL-5 treatments of severe asthma - a systematic review and meta-analysis. Eur Clin Respir J. 2018;5(1):1536097.
140. Pérez de Llano LA, Cosío BG, Domingo C, Urrutia I, Bobolea I, Valero A, et al. Efficacy and Safety of Reslizumab in Patients with Severe Asthma with Inadequate Response to Omalizumab: A Multicenter, Open-Label Pilot Study. J Allergy Clin Immunol Pract. 2019 Jan 21. pii: S2213-2198(19)30069-8.
141. Walsh GM. Dupilumab utility in difficult-to-treat asthma. Immunotherapy. 2019;11(4):261-4.
142. Sulaiman I, Lim JCW, Soo HL, Stanslas J. Molecularly targeted therapies for asthma: Current development, challenges and potential clinical translation. Pulm Pharmacol Ther. 2016;40:52-68.
143. Take Action With DUPIXENT® (dupilumab). Disponível em: https://www.dupixent.com/. Acesso em: junho/2019.
144. Wu AY, Sur S, Grant JA, Tripple JW. Interleukin-4/interleukin-13 versus interleukin-5: a comparison of molecular targets in biologic therapy for the treatment of severe asthma. Curr Opin Allergy Clin Immunol. 2019;19(1):30-7.
145. Carvalho VO, Solé D, Antunes AA, Bau AEK, Kuschnir FC, Mallozi MC, et al. Guia prático de atualização em dermatite atópica - Parte II: abordagem terapêutica. Posicionamento conjunto da Associação Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Pediatria. Arq Asma Alerg Imunol. 2017;1(2):157-82.
146. Zayed Y, Kheiri B, Banifadel M, Hicks M, Aburahma A, Hamid K, et al. Dupilumab safety and efficacy in uncontrolled asthma: a systematic review and meta-analysis of randomized clinical trials. J Asthma. 2018 Oct 1:1-10.
147. Fichtner-Feigl S, Strober W, Kawakami K, Puri RK, Kitani A. IL-13 signaling through the IL-13alpha2 receptor is involved in induction of TGF-beta1 production and fibrosis. Nat Med. 2006;12:99-106.
148. O'Dwyer DN, Moore BB. The role of periostin in lung fibrosis and airway remodeling. Cell Mol Life Sci. 2017;74:4305-14.
149. Matsumoto H. Serum periostin: a novel biomarker for asthma management. Allergol Int. 2014;63:153-60.
150. Li H, Wang K, Huang H, Cheng W, Liu X. A meta-analysis of anti-interleukin-13 monoclonal antibodies for uncontrolled asthma. PLoS ONE. 14(1): e0211790.
151. Liu Y, Zhang S, Chen R, Wei J, Guan G, Zhou M, et al. Meta-analysis of randomized controlled trials for the efficacy and safety of anti-interleukin-13 therapy with lebrikizumab in patients with uncontrolled asthma. Allergy Asthma Proc. 2018;39(5):332-7.
152. Steinke JW. Anti-interleukin-4 therapy. Immunol Allergy Clin North Am. 2004;24:599-614.
153. Pelaia G, Vatrella A, Maselli R. The potential of biologics for the treatment of asthma. Nat Rev Drug Discov. 2012;11:958-72.
154. Corren J, Parnes JR, Wang L, Mo M, Roseti SL, Griffiths JM, et al. Tezepelumab in Adults with Uncontrolled Asthma. N Engl J Med. 2017;377(10):936-46.
155. Kao CC, Parulekar AD. Spotlight on fevipiprant and its potential in the treatment of asthma: evidence to date. J Asthma Allergy. 2019;12:1-5.
156. Bateman ED, Guerreros AG, Brockhaus F, Holzhauer B, Pethe A, Kay RA, et al. Fevipiprant, an oral prostaglandin DP2 receptor (CRTh2) antagonist, in allergic asthma uncontrolled on low-dose inhaled corticosteroids. Eur Respir J. 2017;50(2). pii: 1700670.
157. Kuna P, Bjermer L, Tornling G. Two Phase II randomized trials on the CRTh2 antagonist AZD1981 in adults with asthma. Drug Des Devel Ther. 2016;10:2759-70.
158. Zhu L, Ciaccio CE, Casala TB. Potential new targets for drug development in severe asthma. World Allergy Organ J. 2018;11(1):30.