Número Atual: Julho-Setembro 2020 - Volume 4 - Número 3
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Comunicação Clínica e Experimental
Infecção por SARS-CoV-2 em paciente com agamaglobulinemia ligada ao X tratado com altas doses de imunoglobulina endovenosa e plasma de convalescente
SARS-CoV-2 infection in a patient with X-linked agammaglobulinemia treated with high doses of intravenous immunoglobulin and convalescent plasma
Mariana Jobim1; Tiago Severo Garcia2; Gisele Ewald1; Leo Sekine3; Edino Parolo4; José Augusto Pellegrini4; Patricia Schwarz4; Nicole Santos4; Lavinia Schuler5; Luiz Jobim1,2
DOI: 10.5935/2526-5393.20200056
1. Hospital de Clínicas de Porto Alegre, Serviço de Alergia e Imunologia - Porto Alegre, RS, Brasil
2. Universidade Federal do Rio Grande do Sul, Departamento de Medicina Interna - Porto Alegre, RS, Brasil
3. Hospital de Clínicas de Porto Alegre, Serviço de Hemoterapia - Porto Alegre, RS, Brasil
4. Hospital de Clínicas de Porto Alegre, Serviço de Medicina Intensiva - Porto Alegre, RS, Brasil
5. Universidade Federal do Rio Grande do Sul, Genética - Porto Alegre, RS, Brasil
Endereço para correspondência:
Luiz Jobim
E-mail: ljobim@hcpa.edu.br
Submetido em: 17/10/2020
Aceito em: 18/10/2020
Não foram declarados conflitos de interesse associados à publicação deste artigo
RESUMO
A pandemia pelo vírus SARS-CoV-2 atingiu adultos, crianças e penalizou indivíduos idosos e com comorbidades como diabetes, doença cardíaca, hipertensão e obesidade. A maioria dos infectados são assintomáticos ou têm sintomas leves, entretanto 15% podem apresentar pneumonia e 5% síndrome respiratória aguda grave. Apresentamos um caso de agamaglobulinemia ligada ao X (XLA) em paciente masculino de 27 anos que se infectou com SARS-CoV-2. Os pacientes com XLA não possuem linfócitos B e não produzem anticorpos devido a uma mutação no gene Bruton tirosino-quinase (BTK), responsável pela maturação dos linfócitos B. Ele infectou-se e foi internado em hospital de Ivoti/RS. A evolução da pneumonia foi rápida, necessitando transferência para o Hospital de Clínicas de Porto Alegre (HCPA) no 10° dia de evolução. Iniciou com infusão de imunoglobulinas, tendo utilizado o total de 400 gramas devido ao intenso catabolismo da IgG, mantendo-se sua concentração entre 700-900 mg/dL. Necessitou de ventilação mecânica, oxigenação por membrana extracorpórea (ECMO) e hemodiálise.Foi administrado plasma de convalescente (PC), 300 mL, por duas vezes, com melhora clínico-radiológica e retirada da ventilação mecânica. Piorou e repetiu outras 4 infusões de PC (total de 1717 mL), negativando o vírus na orofaringe (RT-PCR). Em 3 ocasiões teve sepse, debelada rapidamente. Apresentou anemia, com necessidade de transfusão frequente. Identificou-se linfopenia de CD3, CD4, CD8, NK e ausência de linfócitos B. A linfopenia foi revertida com a recuperação clínica e a alta hospitalar aconteceu no 70° dia de internação.
Descritores: COVID-19, SARS-CoV-2, plasma, agamaglobulinemia, imunoglobulinas.
INTRODUÇÃO
A agamaglobulinemia ligada ao X (XLA) ou agamaglobulinemia de Bruton foi a primeira imunodeficiência primária reconhecida e descrita em 1952 pelo pediatra Ogden Bruton, do Hospital Walter Reed, em Washington, EUA. O paciente era um menino de 8 anos de idade que sofria de septicemia recorrente por pneumococo. A eletroforese de proteínas revelou a falta da fração globulina do soro, localização preferencial das imunoglobulinas. Passaram-se 40 anos até que a base genética da XLA fosse decifrada pelo sequenciamento e identificadas mutações no gene da Bruton tirosina-kinase (BTK), enzima fundamental para a maturação dos linfócitos B. Seguiram-se a identificação de mais de 100 mutações nesse gene, localizado no braço longo do cromossomo X. A incidência da doença é estimada em 1: 250.000, sendo que não existe correlação entre os diferentes genótipos e as manifestações clínicas observadas. Essa doença atinge preferencialmente o sexo masculino1.
Na XLA, as imunoglobulinas estão praticamente ausentes, existindo menos de 1% de linfócitos B circulantes. Os principais testes laboratoriais para o diagnóstico são a dosagem das imunoglobulinas e a quantificação das subpopulações linfocitárias por citometria de fluxo. Os centros germinativos nos tecidos linfoides são indetectáveis, assim como as amígdalas palatinas. Os linfócitos T são normais, assim como a arquitetura e tamanho do timo. Durante os primeiros 6 meses de vida, a IgG materna protege esses pacientes, entretanto, com o passar do tempo, os anticorpos diminuem e as infecções bacterianas sino-pulmonares aumentam. As pneumonias tornamse frequentes, assim como o uso dos antibióticos. A infecção crônica tem como consequência o surgimento de bronquiectasias, preferencialmente nos lobos médios e inferiores. Em relação às demais infecções, salientamos a giardíase, sinusites, otites e infecções por enterovírus, resultando por vezes em meningoencefalites2.
O tratamento com a imunoglobulina endovenosa (IGEV) deve ser realizado mensalmente com 500 mg/kg de peso. Os níveis séricos de IgG devem permanecer acima de 700 mg/dL, o que diminui consideravelmente a possibilidade de pneumonias. Mesmo assim, muitos pacientes desenvolvem sinusite crônica e bronquiectasias, devendo-se também tratar as frequentes infestações parasitárias intestinais. O prognóstico é bom para os casos diagnosticados precocemente, antes de surgirem sequelas importantes. O aconselhamento genético deve ser realizado, explicando-se à família que o gene defeituoso pode ser herdado por irmãos do sexo masculino, assim como por sobrinhos homens (filhos de irmãs do paciente) ou mesmo netos, por parte de uma filha do caso índice2.
A defesa imunológica contra os vírus é feita, de forma conjunta, pela imunidade inata e pela imunidade adaptativa. Inicialmente, as partículas virais são fagocitadas pelos macrófagos. A seguir, peptídeos virais expressam-se por intermédio das moléculas HLA na membrana dessas células, sendo finalmente apresentados para as células NK e para os linfócitos
T. Durante o processo de apresentação dos antígenos virais, citocinas e interferon (INF) são também produzidos. As células NK são citotóxicas e têm o poder de destruir células infectadas, de imediato. O INF atua ativando macrófagos e aumentando sua capacidade microbicida. A partir desse momento, a imunidade adaptativa, mais lenta, é recrutada. O linfócito TCD8+ reconhecerá o vírus, apresentado por moléculas HLA de classe I na superfície de células infectadas, seguindo-se a lise das mesmas. O linfócito TCD4+ auxiliará o linfócito B na produção de anticorpos. Os anticorpos ligam-se ao vírus quando esses estiverem fora das células, e neutralizam sua atividade, combatendo a infecção. Além disso, os anticorpos podem ligar-se às células infectadas e reforçar a ação das células NK pela citotoxicidade celular dependente de anticorpo (ADCC)3.
A identificação da Síndrome Respiratória Aguda Grave (ARDS) ocasionada pelo Coronavírus 2 (SARSCoV-2) aconteceu no final de 2019 em Wuhan, China. A doença mediada pelo coronavírus 2019 (COVID19) evoluiu rapidamente em uma pandemia global. A patogênese da COVID-19 grave e sua falência respiratória é pouco conhecida, mas a mortalidade está relacionada com a idade do paciente, sexo masculino e comorbidades como hipertensão, diabetes, obesidade e cardiopatia3.
O novo vírus tem um tropismo acentuado pelos pulmões, causando, em alguns casos, uma pneumonia intersticial com complicações tromboembólicas micro e macro vasculares. Os casos graves têm necessidade de ventilação mecânica (VM), com aumento da mortalidade devido à ARDS.
Não sabemos muito sobre a patogênese dessa nova doença, entretanto, os casos leves devem ser resolvidos pela defesa imunológica padrão contra doenças virais. Os cientistas têm usado o modelo da sepse como protótipo para o entendimento da infecção grave pelo SARS-CoV-2. O vírus pode ativar a resposta imune inata e adaptativa, entretanto, o descontrole da resposta inata pode prejudicar a resposta adaptativa e estimular a inflamação. Isso pode ser observado principalmente pela associação da hipercitocinemia, representada por uma tempestade de citocinas decorrente de ativação de macrófagos, diminuição de linfócitos CD4 e células NK, ocasionando inflamação dos pulmões e de outros órgãos. As alterações da função pulmonar, renal e hepática, associadas com aumento de proteína C-reativa e D-dímeros favorecem esta hipótese3.
O vírus SARS-CoV-2 interage com as células fagocitárias do paciente por intermédio de suas moléculas de sinalização. Essas são ativadas, produzindo uma cascata de fosforilações de fatores de transcrição como o fator nuclear kβ (NF-kβ) e secreção de linfocinas pró-inflamatórias, especialmente o INF-I e INF-III, considerados de grande importância na defesa antiviral. Outras citocinas também têm importância na imunidade inata antiviral e na indução da imunidade adquirida, tais como o fator de necrose tumoral alfa (TNF-α) e as interleucinas IL-1, IL-6 e IL-18. O INF-I pode limitar a infecção se atuar precocemente, entretanto, o SARS-CoV-2 talvez possa suprimir a liberação de INF-I, como acontece com o SARS-CoV-I, provavelmente sendo uma das várias maneiras de evasão. O INF protege no início da doença e pode ser prejudicial na fase tardia. O SARS-CoV-2 induz a produção de IL-6 e IL-8, repressores da NF-kβ. Esse processo pró-inflamatório contribui para a tempestade de linfocinas observada nos pacientes graves. O conhecimento desse delicado balanço entre a atividade da imunidade inata antiviral e a inflamatória é essencial para o entendimento da COVID-19. Observaram-se níveis elevados de IL-6 em diversas coortes de pacientes, existindo correlação com a severidade da doença3.
A resposta imune das mucosas aos agentes infecciosos é orquestrada pelas células mieloides, como as células dendríticas, monócitos e macrófagos. Existe um entendimento que a desregulação da resposta dessas células na COVID-19 estimula à linfopenia, a síndrome de liberação de citocinas e a ARDS. Foi observado, pela citometria de fluxo, que o sangue periférico dos pacientes sintomáticos tem uma quantidade significante de linfócitos T CD4, produzindo fator estimulador de colônias de granulócitos e neutrófilos (GM-CSF) e monócitos inflamatórios3.
As células NK apresentam-se como CD56brightCD16ou CD56dimCD16+, especializadas na produção de citocinas e em causar citotoxicidade, respectivamente. Muitos estudos mostram uma diminuição das NK no sangue dos pacientes com COVID-19, estando associada com a severidade da doença, existindo evidências de que o CXCR3, um receptor de quimiocina, pode facilitar o recrutamento das NK do sangue periférico para o pulmão dos pacientes. Os achados da ativação das células NK na COVID-19 permitem concluir que elas podem contribuir, tanto para a resolução da infecção, quanto para seu agravamento, ocasionando a tempestade de linfocinas. A maioria das células NK do pulmão de pacientes são do tipo indutoras de citotoxicidade em resposta à perda de expressão de HLA de classe I na superfície dos macrófagos infectados. Supõe-se que exista uma dificuldade de maturação das NK no sangue periférico com diminuição de seu número e migração dessas células para o pulmão de pacientes com SARS-CoV-2. Os pacientes com concentração de IL-6 aumentada no sangue são os mesmos com diminuição das NK circulantes3.
Os linfócitos T têm papel importante na resposta imune contra os agentes infecciosos. Nos casos moderados e graves de COVID-19 existe linfopenia com redução de células CD4 e CD8. A linfopenia CD8 correlaciona-se bem com a severidade e mortalidade dos pacientes. Aqueles com sintomas leves têm contagens de linfócitos T normais ou discretamente elevados4.
Os pacientes com infecção pelo SARS-CoV-1 apresentam resposta celular de CD4 e CD8 contra a proteína S, sendo duradoura, talvez ultrapassando os 6-11 anos. No SARS-CoV-2 existem poucos trabalhos, mas a resposta é contra as proteínas internas N e externas S. Enquanto a indução de resposta robusta contra o vírus é essencial para o controle da doença, uma desregulação de resposta celular T pode contribuir para a imunopatologia e severidade da COVID-19. Os linfócitos T regulatórios (Treg) foram encontrados diminuídos em casos graves. De uma maneira geral, os estudos sugerem que na COVID-19 severa os linfócitos T parecem estar mais ativados, exibindo tendência para a exaustão com diminuição da citotoxicidade3.
A resposta imune com linfócitos B é crítica para a eliminação das partículas virais circulantes, assim como é importante para memória imunológica, que previne a reinfecção. O SARS-CoV-2 estimula uma resposta imune humoral robusta com anticorpos IgG, IgA e IgM antivirais, assim como com IgG neutralizante em 7 a 14 dias do início da infecção3.
Até o momento, não existe tratamento antiviral específico para a COVID-19. O Remdesivir foi reportado possuir efeito antiviral, entretanto ainda não conhecemos a eficácia comprovada por estudo controlado. O tratamento com corticosteroide na ARDS tem sido utilizado paralelamente ao uso de ventilação mecânica, anticoagulantes, antibióticos para infecção secundária e fisioterapia. A gravidade das infecções respiratórias virais depende do fino balanço entre a virulência do patógeno e a resposta inflamatória do hospedeiro. Embora uma resposta imune efetiva seja necessária, a observação clínica e dados experimentais indicam que uma excessiva resposta imunológica pode ser responsável pelo dano e deterioração clínica dos pacientes com COVID-19.
A tempestade de linfocinas e a linfopenia são características da doença grave, indicando intensa resposta inflamatória sistêmica. A possibilidade de efeito modulador da IGEV em relação à tempestade de linfocinas tem sido aventada, assim como existe em outras infecções virais. O tratamento com IGEV na dose de 0,3-0,5 mg/kg foi realizado em pacientes com pneumonia severa por COVID-19 sem resposta aos tratamentos convencionais, sendo observada melhora clínica e regressão das lesões pulmonares5.
A utilização precoce de IGEV tem mostrado efetividade quando usada dentro das primeiras 48 h da internação em CTI. Um estudo foi conduzido no CTI do Terceiro Hospital de Wuhan com 58 casos graves de COVID-19 e demonstrou que a mortalidade após 28 dias foi de 23,3% (infusão 20 g dentro das 48 horas) e 57,1% (após as 48 horas) p = 0,009. Os tratados precocemente foram os que se recuperaram clinicamente mais rápido, tiveram menor tempo de internação e usaram menos ventilação mecânica6.
O relato de 3 pacientes graves de COVID-19 tratados com alta dose de IGEV (25 g por 5 dias) demonstrou resultados surpreendentes, especialmente quando feita a administração nos primeiros 7 dias. A conclusão do relato é que a IGEV tem um potente efeito imunomodulador, também observado em doentes com autoimunidade e inflamação crônica7.
A imunoterapia clássica com plasma de convalescente (PC) foi usada no tratamento de diversas infecções virais, como na SARS (Síndrome Respiratória Aguda Grave pelo SARS-CoV1), MERS (Síndrome Respiratória do Oriente Médio) e na epidemia com H1N1 em 2009. Os anticorpos específicos presentes no PC podem realizar seu efeito terapêutico por vários mecanismos. Eles podem ligar-se ao patógeno, neutralizando diretamente sua infectividade, assim como podem ativar o sistema do complemento e a citotoxicidade celular dependente de anticorpo (ADCC), estimulando a fagocitose3.
Em relação à COVID-19, algumas publicações mostraram resultados alentadores na recuperação de pacientes com uso de PC. Em 10 pacientes graves tratados com uma dose de 200 mL de PC, foi observada boa tolerância e aumento significativo de anticorpos neutralizantes, responsáveis pelo desaparecimento da viremia em 7 dias, além de melhora clínica e radiológica8.
Uma revisão recente avaliou a efetividade da terapia com PC em pacientes com COVID-19 baseada nas publicações dessa pandemia. Concluíram que o PC diminui a mortalidade em pacientes severamente afetados, reduz os sintomas clínicos e aumenta os títulos de anticorpos neutralizantes. A maioria dos pacientes negativou o RT-PCR para o SARS-Cov-2 após o tratamento9.
Os resultados do tratamento com PC para pacientes hospitalizados com COVID-19 numa coorte de 3.082 pacientes, mostraram redução da mortalidade naqueles que receberam plasma. A mortalidade em 7 e 30 dias foi reduzida nos pacientes transfundidos nos 3 primeiros dias após o diagnóstico em relação aos transfundidos com mais de 4 dias10.
A administração passiva de anticorpos oferece a única estratégia imediata de conferir imunidade, prevenindo e tratando doenças infecciosas emergentes como a COVID-19, sendo que o volume de plasma infundido varia desde 200 mL até 600 mL. Entretanto, uma metanálise recente sobre uso de PC não chega à conclusão sobre a efetividade do tratamento para pacientes hospitalizados com COVID-19, ressaltando que resultados favoráveis podem ser decorrentes do uso de PC, da história natural da doença, ou de outros tratamentos que os pacientes receberam11.
Poucas são as publicações de pacientes com deficiência de anticorpos infectados com SARS-CoV2. Uma delas refere-se a paciente de 37 anos com XLA, internado por 40 dias com ARDS, refratária ao tratamento. Seu quadro clínico piorou no 15° dia da internação, quando a tomografia mostrou imagem de envolvimento pulmonar extensivo e bilateral, na forma de consolidações nodulares em vidro fosco e infiltrado intersticial. O tratamento com antibióticos e com IGEV (800 mg/kg) não foi efetivo, entretanto no 23° dia foi infundido 200 mL de PC, observando-se em 48 horas o desaparecimento da febre e a negativação do RT-PCR para o vírus no exsudato de orofaringe. No 30° dia, uma semana após a infusão, o Rx de tórax mostrou resolução das lesões pulmonares, acompanhada da melhora do estado clínico12.
Dois outros casos de agamaglobulinemia ligada ao X (XLA) foram reportados com COVID-19. Os pacientes tinham 34 e 26 anos, não apresentavam linfócitos B circulantes e recebiam regularmente infusões de imunoglobulina EV. Ambos apresentaram pneumonia intersticial, acompanhada de febre, tosse, anorexia, associadas com elevação da proteína C-reativa e ferritina. Não foi necessário oxigênio, ventilação mecânica ou internação em CTI13. Depois dessa publicação, alguns autores sugeriram que a imunidade celular pode dar conta da COVID-19, independente da produção de anticorpos e até aventaram a hipótese de que paradoxalmente a falta de linfócitos B possa ser um fator protetor14,15.
Existem alguns casos publicados de pacientes com Imunodeficiência Comum Variável (IDCV) e COVID-19. Um deles refere-se a um homem de 49 anos com história de asma, obesidade mórbida e infecções recorrentes sino-pulmonares. Ele estava há 6 meses sem uso de imunoglobulina quando se infectou e desenvolveu ARDS, necessitando do uso de VM. Foi tratado com IGEV e plasma de convalescente, remdesivir e antibióticos, entretanto não resistiu e foi a óbito16.
Outro caso de IDCV foi de mulher de 53 anos que se apresentou com febre intermitente de 38 °C, calafrios, mialgia, cefaleia, tosse não produtiva, dor toráxica e dispneia. A paciente era portadora de bronquiectasias, além de hipotireoidismo, síndrome de Sjögren e câncer de mama. A paciente foi infundida no 2° dia com IGEV (500 mg/kg), tendo ficado 4 dias em VM, seguida de melhora clínica e alta em 10 dias17.
CASO CLÍNICO
Paciente caucasoide, masculino, 27 anos, foi diagnosticado com agamaglobulinemia ligada ao X (XLA) aos 7 anos. Um irmão faleceu de infecções na infância, não existindo outros casos familiares. O tratamento com imunoglobulina endovenosa (IGEV) foi instituído desde o diagnostico até hoje (500 mg por kg de peso). O paciente não apresentava linfócitos B analisados por citometria de fluxo (CD20). As imunoglobulinas eram praticamente ausentes na época do diagnóstico. Mesmo com IGEV teve alguns episódios de infecção respiratória, otite e diarreia. Faz uso de antiparasitários a cada 6 meses. Recentemente, sua família infectou-se com o SARS-CoV-2. Internou com pneumonia em hospital do interior do RS, onde ficou por 10 dias, tendo resultado negativo para COVID-19 por RT-PCR em esfregaço de oro e nasofaringe. A pneumonia agravou-se e foi transferido para o Hospital de Clínicas de Porto Alegre, onde o mesmo exame foi positivo. Realizou infusão de IGEV (500 mg/kg), foi internado no CTI-COVID-19, colocado em VM e oxigenação por membrana extracorpórea (ECMO). Com o passar do tempo, iniciou terapia renal substitutiva (TRS), assim como fez traqueostomia. O tratamento antiinflamatório constou da sequência de dexametasona, hidrocortisona e metil prednisona. O anti-infeccioso consistiu de meropenem, vancomicina. voriconazol, sulfametoxazol/trimetropim e amicacina. Apresentou anemia importante, sendo necessária várias unidades de concentrado de hemácias.
Foi observada linfopenia durante a fase crítica da doença. Linfócitos totais: 618/µL, CD3: 575/µL, CD4: 301/µL, CD8: 212/µL, NK: 41/µL. A IgG foi mantida acima de 700 mg/dL, havendo necessidade de várias infusões de IGEV, pois a tendência era de rápido catabolismo, provavelmente por perda devido à infecção e aos inúmeros procedimentos realizados. A linfopenia foi revertida com a recuperação clínica. Linfócitos totais: 2020/µL, CD3: 1951/µL, CD4: 1299/µL, CD8: 578/µL e NK: 60/µL. Os linfócitos B foram ausentes em todos os testes de citometria de fluxo.
As diversas radiografias de tórax permitiram observar a evolução da doença, interrompida por breve melhora clinico-laboratorial após realizar as duas primeiras infusões de 300 mL de PC (Figura1). Prescindiu da VM por 4 dias e foi descontinuado o corticosteroide, no entanto a doença progrediu, necessitando novamente de respirador, ECMO, TRS e traqueostomia. Em duas ocasiões esteve infectado com crescimento de bactérias gram-positivas na hemocultura. A inclusão de novos antibióticos fez negativar as culturas.
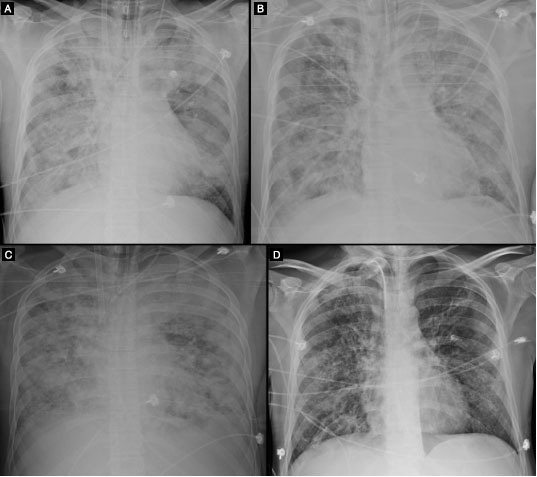
Figura 1 Evolução radiológica do paciente. (A) Radiografia do tórax de 19/08 mostra extensas consolidações em ambos os pulmões; ECMO (cateteres visualizados na veia cava inferior e na veia cava superior); derrame pleural à direita. (B) Radiografia de 24/08 demonstra melhora do quadro radiológico em relação ao exame de 19/08; persistem áreas de consolidação difusas em ambos os pulmões, porém com alguma melhora em relação ao exame de 19/08; persiste derrame pleural à direita. (C) Radiografia de 29/08 evidenciando significativa piora radiológica em relação ao exame de 24/08; extensas consolidações pulmonares bilaterais. (D) Em radiografia de 15/10, observa-se muito significativa melhora do quadro radiológico em relação a 29/08, com regressão das consolidações pulmonares, presença de algumas bronquiectasias esparsas bilateralmente, regressão completa do derrame pleural à direita, traqueostomia
O paciente recebeu um total de 400 g de IGEV, distribuídas em diversas aplicações durante o período de internação. Em relação ao PC, as infusões iniciaram no 12° dia, e totalizaram 6 infusões ao longo de 20 dias, com volumes variando entre 251 a 306 mL cada, somando um volume final de 1717 mL. A concentração de anticorpos IgG anti-SARS-CoV-2 foi mensurada através de quimiluminescência (SARS-CoV-2 Chemiluminescent Immunoassay, Abbott Diagnostics) e os índices medidos nas bolsas infundidas tiveram uma média de 4,12 (desvio padrão: 1,06). As infusões de PC foram interrompidas quando, no 24° dia de internação no CTI, o teste RT-PCR para SARS-CoV2 na secreção de orofaringe resultou negativo.
O paciente teve alta hospitalar após 70° dias de internação, tendo ficado 34 dias em ECMO, VM e hemodiálise.
DISCUSSÃO
Esse caso demonstrou que o tratamento de paciente com COVID-19 e com imunodeficiência primária de anticorpos tem algumas características.
A mais importante é que temos de usar os conhecimentos e a evolução do paciente, sem fixar-nos em protocolos. Devemos usar a IGEV e o PC de maneira liberal, ultrapassando os volumes indicados na literatura, de acordo com acompanhamento radiológico e parâmetros laboratoriais como diminuição da IgG, linfopenia, aumento de proteína C-reativa e D-dímeros. Como poderíamos esperar, os eosinófilos estiveram ausentes do hemograma durante a fase crítica, mas retornaram no início da recuperação, sinalizando o bom prognóstico.
O consumo da IgG pelo paciente foi inesperado, observando-se o aumento após a infusão e a queda abrupta em poucos dias. Esse fato foi observado durante toda a internação do paciente, motivo da quantidade de IGEV usada. Essa particularidade ainda não tinha sido relatada durante a infecção em imunodeficiente com o SARS-CoV-2.
Um ponto desfavorável foi o início de infusões após o 10° dia de internação, sendo que a maioria das publicações demonstra melhor aproveitamento nos primeiros dias da infecção, antes da inflexão para citopenia de células NK, CD4 e CD8, migração de NK ativadas para o pulmão, tempestade de linfocinas e ARDS. No entanto, acreditamos que é possível ter sucesso com uso tardio, tanto com IGEV, como com o PC, pois observamos a melhora clínico-radiológica pós transfusional.
Por 3 vezes foi observada infecção (sepse), tratadas rapidamente com sucesso. Devemos atribuir o resultado da recuperação à idade e robustez do paciente, assim como a utilização de antibioticoterapia efetiva, suporte instrumental com ECMO, hemodiálise e ventilação mecânica, além da fisioterapia e monitorização laboratorial permanente. Somente indivíduos jovens suportam internações longas com suporte desgastante, identificando-se a realidade dessa doença que em 5% dos casos tem inflamação de difícil controle e mortalidade entre mais idosos e doentes.
A impossibilidade de produção de anticorpos antivirais é certamente uma desvantagem e não se pode concordar que a imunidade celular possa resolver sozinha essa infecção, nem que a ausência dos linfócitos B possa ser fator de proteção para a doença. Essas hipóteses foram descartadas por esse caso clínico grave em paciente sem os linfócitos B. Devemos lembrar que esse é o segundo caso de XLA onde o paciente foi tratado com IGEV e PC. Outros dois casos foram mais leves, sendo que entre os de IDCV observamos também casos leves e avançados.
Os pacientes com imunodeficiências devem ser monitorados e tratados com altas doses de IGEV e PC desde o início da infecção, independente da evolução supostamente favorável de alguns. A manutenção de IgG acima de 700 mg/dL é importante como barreira para novas infecções, assim como produz efeito modulador em relação à cascata de linfocinas. A possibilidade de reinfecção deve ser aventada, devido à ausência de anticorpos neutralizantes ao SAR-CoV-2, devendo o paciente realizar o distanciamento social e o uso de máscara futuramente, embora deva ter resposta imune inata e celular ao vírus.
REFERÊNCIAS
1. Buckley RH.Pulmonary complications of primary immunodeficiencies. Paediatr Respir Rev. 2004;5(1):225-33.
2. Winkelstein JA, Marino MC, Lederman HM, Jones SM, Sullivan K, Burks AW, et al. X-linked agammaglobulinemia: report on a United States registry of 201 patients. Medicine (Baltimore). 2006;85(4):193-202.
3. Vabret N, Britton GJ, Gruber C, Hegde S, Kim J, Kuksin M, et al. Immunology of COVID-19: current state of the science. Immunity. 2020;52(6):910-41.
4. WangF, Nie J,Wang H, Zhao Q,Xiong Y, Deng L,et al.Characteristics of Peripheral Lymphocyte Subset Alteration in COVID-19 Pneumonia. J Infect Dis. 2020;221(11):1762-9.
5. Mohtadi N, Ghaysouri A, Shirazi S, Ansari S, Shafiee E, Bastani E, et al. Recovery of severely ill COVID-19 patients by intravenous immunoglobulin (IVIG) treatment: a case series. Virology. 2020;548:1-5.
6. Xie Y, Cao S, Dong H, Li Q, Chen E, Zhang W, et al. Effect of regular intravenous immunoglobulin therapy on prognosis of severe pneumonia in patients with COVID-19. J Infect. 2020;81(2):318-56.
7. Cao W, Liu X, Bai T, Fan H, Hong K, Song H, et al. High-dose intravenous immunoglobulin as a therapeutic option for deteriorating patients with coronavirus disease 2019. Open Forum Infect Dis. 2020;7(3):ofaa102.
8. Duan K, Liu B, Li C, Zhang H, Yu T, Qu J, et al. Effectiveness of convalescent plasma therapy in severe COVID-19 patients. Proc Natl Acad Sci USA. 2020;117(17):9490-6.
9. Rajendran K, Krishnasamy N, Rangarajan J, Rathinam J, Natarajan M, Ramachandran A. Convalescent plasma transfusion for the treatment of COVID-19: systematic review. J Med Virol. 2020 May 1;10.1002/jmv.25961.
10. Joyner MJ, Senefeld JW, Klassen SA, Mills JR, Johnson PW, et al. Effect of convalescent plasma on mortality among hospitalized patients with COVID-19: initial three-month experience. medRxiv. 2020 Aug 12;2020.08.12.20169359.
11. Piechotta V, Chai KL, Valk SJ, Doree C, Monsef I, Wood EM, et al. Convalescent plasma or hyperimmune immunoglobulin for people with COVID‐19:a living systematic review.Cochrane Database Syst Rev. 2020 Jul 10;7(7):CD013600.
12. Mira E, Yarce OA, Ortega C, Fernández S, Pascual NM, Gómez C, et al. Rapid recovery of a SARS-CoV-2-infected X-linked agammaglobulinemiapatient after infusionof COVID-19 convalescent plasma. J Allergy Clin Immunol Pract. 2020;8(8):2793-5.
13. Soresina A, Moratto D, Chiarini M, Paolillo C, Baresi G, Focà E, et al.Two X-linked agammaglobulinemia patients develop pneumonia as COVID-19 manifestation but recover. Pediatr Allergy Immunol. 2020 Apr 22;10.1111/pai.13263.
14. Quinti I, Lougaris V, Milito C, Cinetto F, Pecoraro A, Mezzaroma I, et al. A possible role for B cells in COVID-19? Lesson from patients with agammaglobulinemia. J Allergy Clin Immunol. 2020 Jul;146(1):211-213.e4.
15. Babaha F,RezaeiN.PrimaryimmunodeficiencydiseasesinCOVID19 pandemic: a predisposing or protective factor? Am J Med Sci. 2020 Jul 29;S0002-9629(20)30339-6.
16. Mullur J, Wang A, Feldweg A. A fatal case of coronavirus disease 2019 in a patient with common variable immunodeficiency. Ann Allergy Asthma Immunol. 2020 Aug 18;S1081-1206(20)30573-1. Pubmed PMID: 32818593.
17. Fill L, Hadney L, Graven K, Persaud R, Hostoffer R. The clinical observation of a patient with common variable immunodeficiency diagnosed as having coronavirus disease 2019.Ann Allergy Asthma Immunol. 2020;125(1):112-4.



