Número Atual: Abril-Junho 2020 - Volume 4 - Número 2
- Imprimir
- Indicar
- Estatísticas
- (0)
Comentários - Como Citar
- Download da Citação
- Artigos Relacionados
-
Outros dos
Autores
Artigo de Revisão
Uso de probióticos e/ou prebióticos na prevenção de eczema em crianças com alto risco de atopia: uma revisão sistemática
Probiotics and/or prebiotics use on the prevention of eczema in children with high risk of atopy: a systematic review
Giovanna Delcole; Leonardo Lerro; Matheus Alves Alvares; Natália de Santana Pinto; Rodrigo Ferreira Rodrigues; Vera Esteves Vagnozzi Rullo
DOI: 10.5935/2526-5393.20200025
Centro Universitário Lusíada, Curso de Medicina - Santos, SP, Brasil
Endereço para correspondência:
Giovanna Delcole
E-mail: gicadelcole@gmail.com
Submetido em: 02/04/2020
Aceito em: 22/06/2020
RESUMO
O objetivo deste estudo foi encontrar a relação do uso de probióticos e/ou prebióticos na prevenção do desenvolvimento de eczema atópico em crianças com alto risco. Foram utilizadas para esta revisão as bases de dados MEDLINE, via PubMed, SciELO e LILACS, com os seguintes descritores "(probiotics OR prebiotics) AND (allergy) AND (eczema)". Foram selecionados ensaios clínicos randomizados publicados até janeiro de 2020, sem restrição de idioma, em humanos, desde o nascimento até os 18 anos de idade. Foram recuperados 247 artigos, sendo cinco utilizados para análise. Quatro estudos não demonstraram relação entre o uso de probióticos e/ou prebióticos e a prevenção de eczema atópico em crianças de alto risco. Em contrapartida, um dos trabalhos obteve associação positiva, porém restrito a crianças com alergia à proteína do leite de vaca. Foi concluído nesta revisão que não existe relação entre o uso de probiótico e/ ou prebióticos em crianças de alto risco de atopia na prevenção de eczema, com possível exceção em crianças com alergia ao leite da vaca, com o desenvolvimento de eczema. É necessário a realização de mais estudos em longo prazo para a confirmação de real associação.
Descritores: Dermatite atópica, eczema, probióticos, prebióticos.
INTRODUÇÃO
O eczema atópico, também denominado como dermatite atópica, é caracterizado, na fase aguda, por uma lesão eczematosa mal definida, associada a edema e vesículas e, na fase crônica, por placa eczematosa bem definida, descamativa e com grau variável de liquenificação. A fisiopatologia é multifatorial, incluindo fatores genéticos, alterações na barreira cutânea e imunológicas. Sabe-se que pacientes atópicos apresentam predisposição hereditária a desenvolver hipersensibilidade mediada por IgE. Deste modo, história pessoal e/ou familiar de doenças atópicas conferem alto risco de desenvolver dermatite atópica ao indivíduo. Dentre as consequências do eczema, destaca-se o prurido, podendo variar desde leve até intenso, comprometendo a qualidade de vida do paciente e aumentando a suscetibilidade a infecções cutâneas, podendo ser potencialmente grave1.
Cerca de 60% dos pacientes desenvolvem a dermatite atópica no primeiro ano de vida2, predominantemente antes dos 2 anos3. O estudo International Study of Wheezing in Infants (EISL), que avaliou a prevalência de dermatite atópica no primeiro ano de vida em países da América Central e Europa, encontrou taxas de dermatite atópica de 10,6% (Valencia, Espanha) e 28,2% (San Pedro Sula, Honduras). Já no Brasil, o estudo International Study of Asthma and Allergies in Childhood (ISAAC), observou a porcentagem nacional de 11,5% em escolares de 6 a 7 anos, e de 11,6% especificamente na Região Sudeste4.
Nos últimos anos, o uso de probióticos e prebióticos tem sido estudado na prevenção e terapêutica das doenças alérgicas1. Sendo assim, a sua suplementação nos primeiros anos de vida é considerada uma estratégia atrativa de prevenção primária desse grupo de doenças, incluindo o eczema atópico. O seu uso é baseado na observação de que a microbiota intestinal, nos primeiros anos de vida, possui papel imunorregulatório importante, visto que a falta de equilíbrio em sua composição pode aumentar a suscetibilidade a alergias. Probióticos são microrganismos vivos que contribuem para o equilíbrio da microbiota intestinal por promoverem funções imunorregulatórias por meio da indução celular T via TGF-β, aumentando a produção de interleucinas regulatórias. Já os prebióticos são carboidratos não digeríveis que estimulam a proliferação e/ou atividade de populações de bactérias desejáveis no cólon, sendo assim, regulando microbiota intestinal5.
A literatura atual ainda é controversa em relação ao tema. Portanto, foi realizada esta revisão sistemática sobre o uso de probióticos ou prebióticos na prevenção de doenças alérgicas, em especial o eczema atópico em crianças de alto risco.
METODOLOGIA
Esta revisão sistemática de ensaios clínicos controlados randomizados, realizado até dia 5 de maio de 2020, avaliou a relação entre o uso de probióticos e/ou prebióticos e a prevenção de eczema em crianças com alto risco para o mesmo. Os artigos foram selecionados através de uma estratégia de busca estruturada nos bancos de dados MEDLINE, via PubMed, SciELO e LILACS. Os seguintes descritores de busca foram utilizados: (probiotics OR prebiotics) AND (allergy) AND (eczema), assim como os seguintes termos do Medical Subjects Heading (Mesh): probiotics, prebiotics, allergy, eczema.
Foram incluídos ensaios clínicos randomizados controlados em faixa etária pediátrica (do nascimento aos 18 anos), com indivíduos de ambos os sexos, que avaliaram a eficácia de probióticos e prebióticos no tratamento do eczema atópico, sem restrições de idioma para a análise.
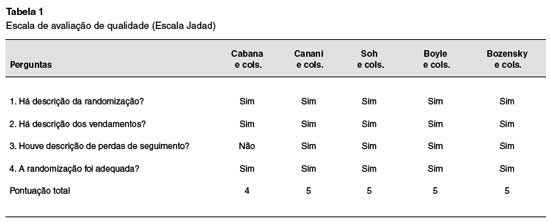
Foram excluídos 59 artigos pelos seguintes motivos: (1) inclusão de gestantes ou lactantes tratadas com probióticos e/ou prebióticos; (2) não avaliaram a relação direta entre o uso de probióticos e/ou prebióticos no desenvolvimento de eczema; (3) trabalhos que focaram no tratamento de uma população diagnosticada com dermatite atópica; (4) outros desenhos de estudo que não foram excluídos com a aplicação do filtro "ensaios clínicos randomizados"; (5) população estudada de faixa etária não pediátrica; (6) crianças sem risco de atopia. Os estudos considerados adequados foram submetidos à Escala de Jaddad6, obtiveram pontuação maior ou igual a três, o que pode ser observado na Tabela 1. Desta forma, cinco ensaios clínicos randomizados foram incluídos para análise. O processo de seleção dos artigos pode ser observado na Figura 1.
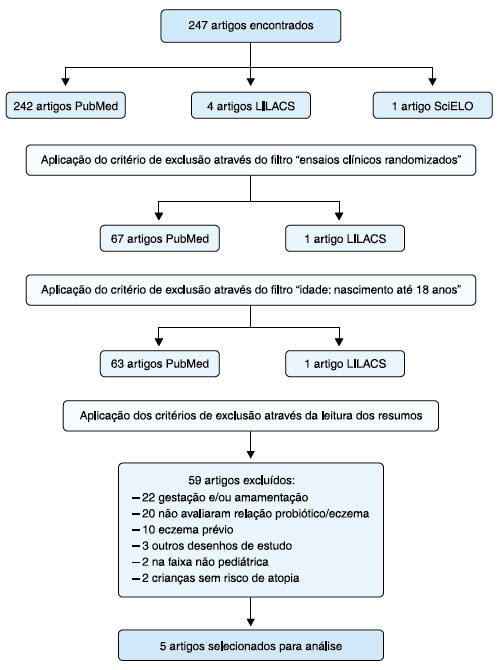
Figura 1. Fluxograma dos estudos incluídos na análise.
RESULTADOS
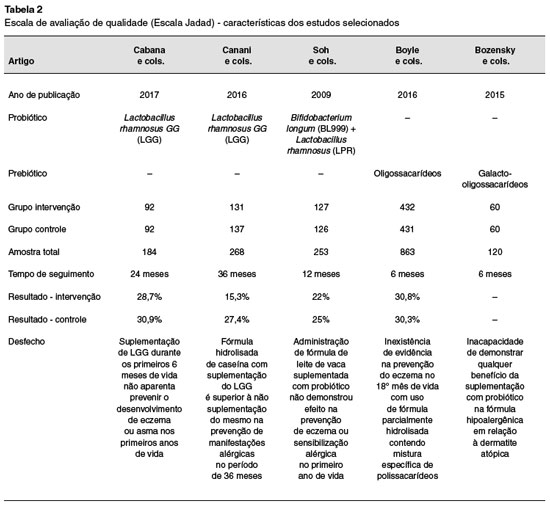
Os cinco trabalhos selecionados são ensaios clínicos randomizados (ECR), sendo três deles ECRs que avaliaram apenas probióticos, e dois que avaliaram prebióticos. Totalizaram-se 649 pacientes avaliados com probióticos e 966 com prebióticos. As características de cada estudo estão detalhadas na Tabela 2.
O estudo de Boyle e cols.7 avaliou 863 crianças de 0 a 18 meses. Alto risco para doença atópica foi determinado quando pelo menos um dos pais tivessem história de doença alérgica documentada, confirmada com prick test ou história de anafilaxia. Foram excluídos pacientes com história de: gemelaridade, anormalidades congênitas graves ou doença neonatal grave, prematuridade ou baixo peso ao nascer e consumo de fórmula com leite de vaca antes da randomização. As mães foram orientadas a interromper a amamentação no período de 4 a 6 meses de idade da criança, de acordo com protocolos internacionais. Sendo assim, famílias que decidiram pelo uso da fórmula antes da 18ª semana foram randomizadas para intervenção ou controle. Se a fórmula foi introduzida após a 18ª semana, os pacientes não foram randomizados e receberam fórmula comum de livre escolha, desta forma, foram considerados grupo amamentado de referência. Pacientes do grupo intervenção receberam fórmula não ultrafiltrada hidrolisada baseada em whey com uma mistura específica de oligossacarídeos em concentração total de 0,8 g/100 mL. O tempo de seguimento foi de 18 meses. O desfecho primário avaliado foi a incidência cumulativa de eczema no 12º mês em crianças que iniciaram a fórmula antes de 4 semanas (subgrupo "introdução precoce"). O secundário, por sua vez, avaliou a incidência cumulativa de eczema no 12º mês em todas as crianças randomizadas (subgrupo "todos os randomizados"). Além disso, foi avaliado o tempo de início do eczema, severidade do eczema por SCORAD (Scoring Atopic Dermatitis) no início da sua apresentação, sintomas gastrointestinais e parâmetros imunológicos. Nesse artigo o eczema foi diagnosticado pelo critério modificado de Hanifin e Rajka (rash pruriginoso pela face e/ou extensores de curso crônico e recidivante). Sua severidade e curso foram avaliados usando SCORAD no momento do diagnóstico, 4 e 8 semanas depois. Por fim, a conclusão desse estudo foi a inexistência de evidência na prevenção do eczema no 18º mês de vida com uso de fórmula parcialmente hidrolisada contendo mistura específica de polissacarídeos.
Cabana e cols.8 conduziram estudo com 184 pacientes com predisposição à doença alérgica, sendo necessário pelo menos um pai ou mãe com histórico de asma. Foram considerados critérios de inclusão o alto risco de manifestação alérgica conforme o critério mencionado e pais fluentes em inglês ou espanhol. Excluíram-se indivíduos com deformidades congênitas, doença aguda durante recrutamento ou qualquer outra condição que afetasse a ingestão de alimento ou o metabolismo. Outros dados que foram levados em consideração na análise foram o tipo de parto (cesariana vs. vaginal) e a duração do período de amamentação. Os pacientes foram randomizados em dois grupos de 92 indivíduos cada. O grupo intervenção recebeu uma cápsula diária, durante os seis primeiros meses de vida, de 10 bilhões de unidades formadoras de colônias (UFC) do Lactobacillus rhamnosus gg (LGG) com 225 mg de inulina; enquanto o grupo controle recebeu, durante o mesmo período, somente 325 mg de inulina. O desfecho primário avaliado foi a incidência cumulativa de eczema no 12º mês, constatada no exame físico com base nos critérios de Hanifin e Rajka ou mediante relato de diagnóstico prévio por um clínico geral em duas ocasiões diferentes, segundo os pais. A conclusão foi que em crianças de alto risco a suplementação precoce de LGG durante os primeiros seis meses de vida não aparenta prevenir o desenvolvimento de eczema ou asma nos primeiros dois anos de vida.
Bozensky e cols.9 realizaram um estudo com 120 pacientes na faixa etária pediátrica, no qual foram incluídas crianças a termo, contendo pais ou irmãos com história positiva de alergias (como eczema atópico, rinite alérgica e/ou asma), término da amamentação antes das 6 semanas de vida (com termo de consentimento assinado por ambos os pais) e com média de 6 a 8 semanas de idade. Os critérios de exclusão foram crianças amamentadas, em uso de alguma fórmula que não fosse hipoalergênica e com desordens gastrointestinais. Vale ressaltar que no momento da inclusão as crianças passaram a ser alimentadas com fórmula hipoalergênica. As crianças foram randomizadas em grupo intervenção e controle. No primeiro, receberam fórmula, com proteína hidrolisada e no segundo, receberam fórmula idêntica com suplementação de 0,5 g/100 mL do prebiótico Galacto-oligossacarídeos (GOS). O tempo de seguimento da pesquisa foi de 6 meses. O desfecho primário avaliado foi a diferença entre a média dos valores de SCORAD entre 3 e 6 meses de idade do grupo controle e intervenção. No desfecho secundário foram avaliados média de peso, altura, circunferência cefálica, frequência e consistência de evacuações, vômito, incidência de infecção e possíveis eventos adversos. O eczema foi mensurado pelo critério SCORAD. A conclusão do artigo foi a incapacidade de demonstrar qualquer benefício da suplementação com prebiótico na fórmula hipoalergênica em relação à dermatite atópica.
No estudo realizado por Soh e cols.5, foram selecionadas 245 crianças com alto risco para doença alérgica, sendo critério para tal, um parente de primeiro grau diagnosticado com asma por médico, rinite alérgica ou eczema e prick test de pele positivo para os ácaros Dermatophagoides pteronyssinus e/ ou Blomia tropicalis. Essa população foi randomizada para receber, se alocadas para o grupo de intervenção, fórmula com 60 mL de Bifidobacterium longum (BL999) 1x107 UFC/g e Lactobacillus rhamnosus (LPR) 2x107 UFC/g diariamente durante os seis primeiros meses de vida, e se alocadas para o grupo controle, apenas a fórmula durante o mesmo período. Para essa análise, foram incluídas crianças de alto risco para doença alérgica conforme critério já mencionado, idade gestacional de pelo menos 35 semanas, peso ao nascer maior que 2 Kg, ausência de malformações congênitas ou doenças importantes. Os critérios de exclusão se baseiam em pais incapazes mentalmente ou legalmente de seguir o consentimento informado e pais que escolheram amamentação materna exclusiva. O desfecho primário foi a incidência cumulativa de eczema, que foi definido de acordo com o critério modificado de Hanifin e Rajka, avaliado ao 12º mês de vida. Já a avaliação do desfecho secundário foi a sensibilização aos alérgenos via IgE sérico total e prick test. Foi concluído que a administração precoce de fórmula de leite de vaca suplementada com probiótico não demonstrou efeito na prevenção de eczema ou sensibilização alérgica no primeiro ano de vida em crianças com alto risco.
No estudo de Canani e cols.10, foram avaliadas, por três anos, 220 crianças de 1 a 12 meses de idade com suspeita de alergia à proteína do leite de vaca (APLV) mediada por IgE. Essas crianças foram acessadas através do relato de consecutivas idas ao pediatra da família devido à recente ocorrência de sinais e sintomas possivelmente relacionados a APLV mediada por IgE. Tais crianças foram encaminhadas a centros pediátricos de alergias terceirizados para possível inclusão no estudo. Foram excluídas crianças com história de anafilaxia induzida por APLV, síndrome enterocolítica induzida por proteínas alimentares, outras alergias alimentares, outras doenças alérgicas, eczema atópico não relacionado a APLV, desordem eosinofílica do trato gastrointestinal, doença sistêmica crônica, defeitos cardíacos congênitos, tuberculose ativa, doenças autoimunes, imunodeficiência, síndrome inflamatória intestinal, doença celíaca, fibrose cística, doenças metabólicas, malignidades, doença pulmonar crônica, má formação dos tratos respiratório e gastrointestinal, administração de prebióticos ou uso de prebióticos durante quatro semanas antes da avaliação. Inicialmente foi realizado prick test em todas as crianças do trabalho que foram randomicamente alocadas em dois grupos. O grupo 1 recebeu somente fórmula hidrolisada de caseína, e o grupo 2 a mesma fórmula com o probiótico Lactobacillus rhamnosus GG (LGG) com dose variando entre 2,5x107 e 5x107 UFC/g. No artigo, o eczema atópico foi diagnosticado baseado em prurido, distribuição e morfologia típica, curso crônico ou recidivante e história pessoal ou familiar de atopia. Como desfecho primário, observou-se a ocorrência de qualquer manifestação alérgica (eczema, urticária, asma ou rinoconjuntivite) durante os 36 meses de estudo.
No secundário, foi a aquisição de tolerância ao leite de vaca no 12º, 24º e 36º mês. Concluiu-se que a fórmula hidrolisada de caseína com suplementação do LGG é superior à não suplementação do mesmo na prevenção de manifestações alérgicas no período de 36 meses.
DISCUSSÃO
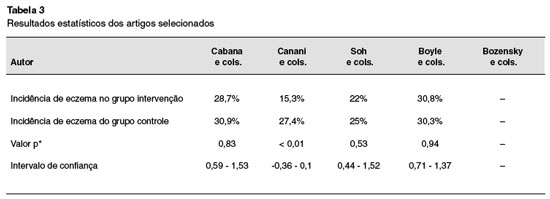
A incidência de eczema no trabalho de Cabana e cols. foi de 30,9% no grupo controle, e de 28,7% no grupo intervenção, com valor de p = 0,83, e intervalo de confiança (IC) = 0,59-1,53. Já Soh e cols. obtiveram incidência de eczema de 25% no grupo controle, e 22% no grupo de intervenção, com valor de p = 0,53 e IC = 0,44-1,52. Boyle e cols. obtiveram 30,3% de casos de eczema no grupo controle, e 30,8% no grupo intervenção, com valor de p = 0.94 e IC = 0,71-1,37. No estudo de Bozensky e cols., o método de avaliação foi baseado na comparação entre os resultados de ambos os grupos, segundo o critério SCORAD. Nenhum dos trabalhos acima citados demonstrou significância estatística, ou seja, não houve relação entre o uso do probiótico e/ou prebiótico e a prevenção do eczema. Já o trabalho de Canani e cols. foi o único que resultou em associação estatisticamente significante, com incidência de eczema de 27,4% no grupo controle, e 15,3% no grupo intervenção, valor de p < 0,001 e intervalo de confiança de -0,36 a -0,1. Valores estatísticos dos artigos podem ser observados na Tabela 3.
Podemos observar que não houve homogeneidade quanto ao tipo de intervenção entre trabalhos. Cabana e cols. e Canani e cols. utilizaram o probiótico Lactobacillus rhamnosus GG (LGG), sendo que o primeiro o utilizou na dose de 1x107 UFC diárias, enquanto o segundo utilizou entre 2,5x107 e 5x107 UFC/g, com nível garantido de pelo menos 1,46x107 UFC/g11. Vale ressaltar que esse trabalho foi o único positivo e utilizou a maior dose de probiótico, podendo ter sido um fator que influenciou tal resultado. Soh e cols., por sua vez, foram os únicos que utilizaram dois tipos de probióticos: Bifidobacterium longum (BL999) + Lactobacillus rhamnosus (LPR). Essa associação pode ter interferido em resultados, potencialmente positivos, que os probióticos teriam individualmente. Boyle e cols. e Bosensky e cols., utilizaram prebióticos como intervenção, uma mistura de oligossacarídeos (scGOS, IcFOS e ácido pAOS) na concentração total de prebióticos de 0,8 g/100 mL; e galacto-oligossacarídeos (GOS) à 0,5 g/100 mL, respectivamente. Mesmo utilizando doses e associações de prebióticos diferentes, ambos os trabalhos obtiveram resultados negativos na prevenção do eczema.
Um fator importante que diverge entre os trabalhos e deve ser analisado é o tempo de amamentação que cada grupo recebeu, devido a efeitos como sua interferência com a microbiota intestinal da criança e, consequentemente, com o desenvolvimento de eczema. No estudo de Cabana e cols., a amamentação materna teve mediana de duração de 10,5 meses, enquanto em estudos como o de Bozensky e cols. e Boyle e cols., durou, respectivamente, até 6 semanas e entre 4 a 6 meses. Portanto, mesmo com durações diferentes do tempo de amamentação, que seria fator protetor no desenvolvimento de eczema, não foi observado resultado estatisticamente significante no estudo com maior duração do aleitamento.
Esta revisão da literatura avalia a população pediátrica com alto risco para desenvolver eczema, porém cada artigo considerou critérios diferentes para essa classificação. Canani e cols. realizaram o trabalho com crianças já diagnosticadas com APLV, diferentemente dos outros trabalhos que levaram em consideração apenas o histórico familiar de doença atópica, o que pode explicar a associação positiva encontrada. Portanto, é possível que o uso do probiótico LGG possa ser benéfico na prevenção de eczema, especificamente para crianças já diagnosticadas com alergia ao leite de vaca. Os trabalhos de Boyle e cols., Bozensky e cols., e Soh e cols., por sua vez, incluíram história de doenças alérgicas em familiares. Já o trabalho de Cabana e cols. incluiu apenas um tipo de doença, a asma, o que pode comprometer a avaliação de outras crianças possivelmente atópicas que se beneficiariam da intervenção com LGG.
Os trabalhos de Canani e cols., Soh e cols. e Boyle e cols. utilizaram o critério de Hanifin e Rajka para caracterizar o eczema, que consiste em rash pruriginoso pela face e/ou extensores de curso crônico e recidivante. Além desse critério, o trabalho de Boyle e cols. avaliou também a severidade e curso pelo SCORAD, ferramenta clínica amplamente utilizada na caracterização da extensão e gravidade do eczema, no momento da apresentação do eczema e após 4 a 6 semanas. O trabalho de Bozensky e cols. foi o único que não utilizou nenhum critério para diagnosticar de fato o eczema, foi utilizado o SCORAD como forma de comparação clínica de seu curso, sendo o objetivo do trabalho obter um SCORAD menor ao final da intervenção comparado com resultados iniciais. O trabalho de Cabana e cols., além de utilizar o critério de Hanifin e Rajka, também diagnosticou eczema a partir de relatos de diagnósticos prévios feitos por médicos em pelo menos duas ocasiões, o que potencialmente pode ter introduzido vieses, por não se saber ao certo o critério diagnóstico que foi utilizado.
Em relação à idade em que foi iniciada a intervenção, todos os trabalhos apresentaram semelhança, uma vez que a administração de probiótico e/ou prebiótico ocorreu durante os primeiros 6 meses de vida. No entanto, a idade de avaliação foi variada: Bozensky e cols. aos 6 meses, Soh e cols. e Boyle e cols. aos 12 meses, Cabana e cols. aos 2 anos, e Canani e cols. aos 41 meses (em média). Um maior tempo de seguimento possivelmente é um fator que possa interferir na positividade dos resultados, como ocorreu no estudo de Canani e cols., com a maior duração dentre os analisados. Estudos que acompanham o efeito do probiótico e/ou prebiótico a longo prazo podem indicar resultados mais promissores sobre possíveis relações entre seu uso na proteção do desenvolvimento de eczema.
Como já citado, o único trabalho com resultado positivo foi o de Canani e cols. Diversos fatores podem ter contribuído para esse resultado: seleção do critério de alto risco para o desenvolvimento de eczema em crianças diagnosticadas com APLV, maior tempo de seguimento, o que permite maior exposição a gatilhos ambientais e potenciais alérgenos, e portanto maior chance de aparecimento do eczema; e o fato do desenvolvimento de eczema não ter sido o objetivo principal analisado. O foco do estudo foi o aparecimento de manifestações alérgicas em geral (eczema, urticária, asma, rinoconjuntivite), portanto, o desenvolvimento de eczema, segundo os autores, deve apenas ser utilizado com o propósito de gerar hipóteses.
A literatura atual é divergente em relação ao efeito benéfico, ou não, dos probióticos na prevenção do eczema. A World Allergy Organization (WAO)12, de acordo com último guideline sobre o tema (2016), afirma que poderia haver benefício, porém, com evidência de baixa qualidade. Ressaltando que foram utilizados estudos de metodologia heterogênea, com intervenção tanto na mãe (durante a gestação e amamentação) quanto nas crianças, ao contrário dos trabalhos incluídos nessa revisão, que abrangem somente o uso em crianças. Além disso, o guideline não especifica o momento de introdução da intervenção, a duração e o tipo de lactobacilo para tal vantagem no uso dos probióticos.
Metanálises recentes também vão de acordo com o encontrado em nosso estudo. Panduru e cols.13 (2015) conduziram uma metanálise utilizando probióticos na prevenção do eczema e concluíram que pode haver um benefício caso fosse realizada a intervenção no período pré e pós-natal. Observaram, em contrapartida, que o uso somente na fase pós-natal não demonstrou benefício estatisticamente significativo. Zuccoti e cols.14 (2015) também concluíram que parece haver um benefício do uso de probióticos na redução do eczema, sobretudo, quando a administração é feita no momento pré-natal. Em oposição, no trabalho de Azad e cols.15 (2013) não houve benefício significativo na utilização neste mesmo momento.
CONCLUSÃO
Não foi demonstrado benefício no uso de probióticos e/ou prebióticos na prevenção do desenvolvimento de eczema quando administrados exclusivamente na população pediátrica de risco. Quando utilizado como critério de risco somente crianças diagnosticadas com APLV, observou-se associação positiva. Logo, o uso de probióticos na prevenção de eczema pode ter efeito positivo exclusivamente nessa população, não tendo benefício aparente em crianças com os demais critérios de risco.
REFERÊNCIAS
1. Antunes AA, Solé D, Carvalho VO, Bau AEK, Kuschnir FC, Mallozi MC, et al. Guia prático de atualização em dermatite atópica -Parte I: etiopatogenia, clínica e diagnóstico. Posicionamento conjunto da Associação Brasileira de Alergia e Imunologia e da Sociedade Brasileira de Pediatria. Arq Asma Alerg Imunol. 2017;1(2):131-56.
2. Simão HL e Departamento de Alergia e Imunologia da SBP. Atualização em Dermatite Atópica. 2017 [Internet]. Disponível em: https://www.sbp.com.br/fileadmin/user_upload/pdfs/dermatite_ atopica.pdf
3. Ministério da Saúde. Dermatologia na Atenção Básica de Saúde: Cadernos de Atenção Básica Nº 9 -Eczema.Brasília;2002 [Internet]. Disponível em: https://bvsms.saude.gov.br/bvs/publicacoes/guiafinal9.pdf. Acessado em: janeiro/2020.
4. Solé D, Wandalsen GF, Camelo-Nunes IC, Naspitz CK; ISAAC - Brazilian Group. Prevalence of symptoms of asthma, rhinitis, and atopic eczema among Brazilian children and adolescents identified by the International Study of Asthma and Allergies in Childhood (ISAAC) - Phase 3. J Pediatr (Rio J). 2006;82(5):341-6.
5. Soh SE, Aw M, Gerez I, Chong YS, Rauff M, Ng YPM, et al.Probiotic supplementation in the first 6 months of life in at risk Asian infants - effects on eczema and atopic sensitization at the age of 1 year. Clinical & Experimental Allergy, 39:571-8. Disponível em: https://onlinelibrary.wiley.com/doi/abs/10.1111/j.1365-2222.2008.03133.x. Acessado em: janeiro/2020.
6. Jadad AR, Moore RA, Carroll D, Jenkinson C, Reynolds DJ, Gavaghan DJ, et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials. 1996 Feb;17(1):1-12.
7. Boyle RJ, Tang ML, Chiang WC, Chua MC, Ismail I, Nauta A, et al.; PATCH study investigators. Prebiotic-supplemented partially hydrolysed cow's milk formula for the prevention of eczema in high-risk infants: a randomized controlled trial. Allergy. 2016;71(5):701-10.
8. Cabana MD, McKean M, Caughey AB, Fong L, Lynch S, Wong A, et al. Early probiotic supplementation for eczema and asthma prevention:a randomized controlled trial. Pediatrics. 2017;140(3):e20163000.
9. Bozenský J, Hill M, Zelenka R, Skýba T. Prebiotics do not influence the severity of atopic dermatitis in infants: a randomised controlled trial. PLoS One. 2015;10(11):e0142897.
10. Berni Canani R, Sangwan N, Stefka AT, Nocerino R, Paparo L, Aitoro R, et al.Lactobacillus rhamnosus GG-supplemented formula expands butyrate-producing bacterial strains in food allergic infants. ISME J. 2016 Mar;10(3):742-50.
11. Berni Canani R, Nocerino R, Terrin G, Coruzzo A, Cosenza L, Leone L, et al. Effect of Lactobacillus GG on tolerance acquisition in infants with cow's milk allergy: a randomized trial. J Allergy Clin Immunol. 2012 Feb;129(2):580-2.
12. Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, et al. World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Probiotics. World Allergy Organ J. 2015 Jan 27;8(1):4. doi: 10.1186/s40413015-0055-2. eCollection 201.
13. Panduru M, Panduru NM, Salavastru CM, Tiplica GS. Probiotics and primary prevention of atopic dermatitis: a meta-analysis of randomized controlled studies. J Eur Acad Dermatol Venereol. 2015 Feb;29(2):232-42.
14. Zuccotti G, Meneghin F, Aceti A, Barone G, Callegari ML, Di Mauro A, et al.Probiotics for prevention of atopic diseases in infants:systematic review and meta-analysis. Allergy. 2015 Nov;70(11):1356-71. doi: 10.1111/all.12700. Epub 2015 Aug 13.
15. Azad MB, Coneys JG, Kozyrskyj AL, Field CJ, Ramsey CD, Becker AB, et al. Probiotic supplementation during pregnancy or infancy for the prevention of asthma and wheeze: systematic review and meta-analysis. BMJ. 2013 Dec 4;347:f6471. doi: 10.1136/bmj. f6471.
16. Sun D, Ong PY. Infectious Complications in Atopic Dermatitis. Immunol Allergy Clin North Am. 2017;37(1):75-93.
17. Kido-Nakahara M, Furue M, Ulzii D, Nakahara T. Itch in Atopic Dermatitis. Immunol Allergy Clin North Am. 2017;37(1):113-22.
18. Ehlayel MS, Bener A, Sabbah A. Montelukast treatment in children with moderately severe atopic dermatitis. Eur Ann Allergy Clin Immunol. 20039(7):232-6.
19. Porto AC, Simão HM. Dermatite Atópica. In: Lopez FA, Campos Jr. D. Tratado de Pediatria: Sociedade Brasileira de Pediatria. 2ª ed. Barueri: Manole; 2010. p. 577-89.
20. Roxo Jr. P. Dermatite atópica. In: Roxo Jr. P (ed.). Alergia e Imunodeficiências em Pediatria -Abordagem Prática.1ªed.Ribeirão Preto: Tecmed; 2006. p. 23-41.
21. Ellwood P, Asher MI, Beasley R, Clayton TO, Stewart AW; ISAAC Steering Committee.The international study of asthma and allergies in childhood (ISAAC): phase three rationale and methods. Int J Tuberc Lung Dis. 2005;9(1):10-6.
22. Fernández-Mayoralas DM, Caballero JM, Alvarez LG.Prevalencia de la dermatitis atópica en escolares de Cartagena y su relación con el sexo y la contaminación. An Pediatr (Barc). 2004;60(6):555-60.
23. Lee J, Seto D, Bielory L.Meta-analysis of clinical trials of probiotics for prevention and treatment of pediatric atopic dermatitis.J Allergy Clin Immunol. 2008;121:116-21, e11.
24. Moro G, Arslanoglu S, Stahl B, Jelinek J, Wahn U, Boehm G. A mixture of prebiotic oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age. Arch Dis Child. 2006;91(10):814-9.
25. Infant and young child feeding;2019.Infant and young child feeding [site na Internet].Disponível em:http://www.data.unicef.org/nutrition/iycf. Acessado em: janeiro/2020.
26. Simpson EL, Chalmers JR, Hanifin JM, Thomas KS, Cork MJ, McLean WH, et al. Emollient enhancement of the skin barrier from birth offers effective atopic dermatitis prevention. J Allergy Clin Immunol. 2014;134(4):818-23.
27. de Silva D, Geromi M, Halken S, Host A, Panesar SS, Muraro A, et al. Primary prevention of food allergy in children and adults: systematic review. Allergy. 2014;69:581-9.
28. Arslanoglu S, Moro GE, Boehm G, Wienz F, Stahl B, Bertino E. Early neutral prebiotic oligosaccharide supplementation reduces the incidence of some allergic manifestations in the first 5 years of life. J Biol Regul Homeost Agents. 2012;26(3 Suppl):49-59.
29.Kunz B, Oranje AP, Labrèze L, Stalder JF, Ring J, Taïeb A. Clinical validation and guidelines for the SCORAD index: consensus report of the European Task Force on Atopic Dermatitis. Dermatology. 1997;195(1):10-9.
30. Hill C, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, et al. Expert consensus document.The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014;11(8):506-14.
31. Martin JA, Hamilton BE, Osterman MJ. Births in the United States, 2014. NCHS Data Brief. 2015 Sep;(216):1-8.
32. Sun W, Svendsen ER, Karmaus WJ, Kuehr J, Forster J. Early-life antibiotic use is associated with wheezing among children with high atopic risk: a prospective European study. J Asthma. 2015;52(7):647-52.
33. Engorn B, Flerlage J. The Harriet Lane Handbook. Table 23.4. 20ª ed. Philadelphia: Elsevier, Saunders; 2015.
34. Kalliomäki M, Salminen S, Poussa T, Isolauri E. Probiotics during the first 7 years of life: a cumulative risk reduction of eczema in a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2007 Apr;119(4):1019-21.
35. Cabana MD, McKean M, Wong AR, Chao C, Caughey AB.Examining the hygiene hypothesis:the trial of infant probiotic supplementation. Paediatr Perinat Epidemiol. 2007;21(Suppl 3):23-8.
36. Arslanoglu S, Piemontese P, Eisses A, Macheiner M, et al.Prevention of early atopic dermatitis by an infant formula supplemented with immunoactive prebiotics in low atopy risk infants. Allergy. 2008;63:615.